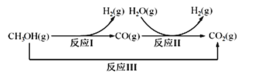
题目内容
【题目】Ⅰ、已知:SiHCl3在催化剂作用下可发生如下反应:
2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g) ΔH1=+48kJ·mol1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3(g) ΔH2=30kJ·mol1
(1)写出由SiHCl3(g)分解产生SiH4(g)和SiCl4(g)的热化学方程式为__。
Ⅱ、298K时,溶液中存在如下反应:A(aq)![]() B(aq)+H2O(l) ΔH>0,物质A的初始浓度为0.180mol·L-1,测得物质B的浓度随时间变化的数据如表所示:
B(aq)+H2O(l) ΔH>0,物质A的初始浓度为0.180mol·L-1,测得物质B的浓度随时间变化的数据如表所示:
t/min | 0 | 21 | 50 | 80 | 100 | 120 | 160 | 220 |
|
c/(mol·L-1) | 0 | 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
回答下列问题:
(2)该反应在50~80min内的平均反应速率为__mol·L1·min1。
(3)120min时A的转化率为__。
(4)298K时,该反应的平衡常数K=__,升温时平衡常数__(填“增大”、“减小”、或“不变”)。
(5)为提高A的平衡转化率,除适当控制反应温度外,还可采取的措施是__。
(6)下列叙述可说明可逆反应已达平衡的是__。
A.c(A)=c(B)
B.A和B反应速率相等
C.A和B的物质的量比值保持恒定
D.溶液的总质量保持恒定
【答案】4SiHCl3(g)=SiH4(g)+3SiCl4(g) △H=+114kJmol-1 0.0007 50% 2.75 增大 及时分离出产物γ-丁内酯的方法,或使用浓硫酸作催化剂、吸水剂 C
【解析】
(1)已知:①2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g) ΔH1=+48kJ·mol1
②3SiH2Cl2(g)=SiH4(g)+2SiHCl3(g) ΔH2=30kJ·mol1
根据盖斯定律,由①![]() 3+②得反应4SiHCl3(g)=SiH4(g)+3SiCl4(g) △H=+114kJmol-1;
3+②得反应4SiHCl3(g)=SiH4(g)+3SiCl4(g) △H=+114kJmol-1;
(2)根据化学反应速率的概念:
![]() mol·L-1·min-1;
mol·L-1·min-1;
(3)120min的转化率=![]() ;
;
(4)298K时,K=![]() 2.75;
2.75;
(5)提高转化率,就是使平衡右移,可以采用及时分离出产物γ-丁内酯的方法,或使用浓硫酸作催化剂、吸水剂;
(6)A.化学平衡状态是正逆反应速率相同,各组分浓度不变,A、B的浓度相同不能证明反应达到平衡,选项A错误;
B.A和B反应速率相等,满足化学反应速率之比等于计量数之比,但不能说明正逆反应速率相等,不能证明反应达到平衡,选项B错误;
C.A和B的物质的量比值保持恒定,则各组分浓度保持不变,反应达平衡状态,选项C正确;
D.根据质量守恒,溶液的总质量始终保持恒定,不能证明反应达到平衡,选项D错误;
答案选C。

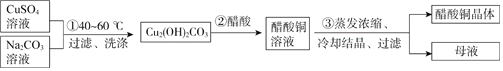
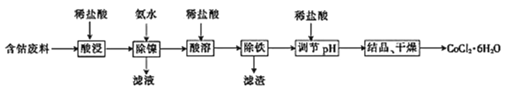
【题目】常温下,用含钴废料(主要成分为CoCO3,还含有少量NiCO3与铁屑)制备CoCl26H2O的工艺流程如图。
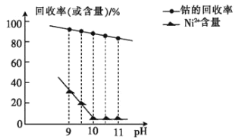
①已知除镍过程中溶液pH对钴的回收率及Ni2+含量的影响如图所示。
②部分金属阳离子在实验条件下开始沉淀和完全沉淀的pH如表所示:
金属阳离子 | 开始沉淀pH | 完全沉淀pH |
Fe3+ | 1.5 | 4.0 |
Fe2+ | 7.5 | 9.7 |
Co2+ | 6.6 | 9.4 |
Ni2+ | 7.7 | 9.5 |
回答下列问题:
(1)酸浸后溶液中的阳离子为:Co2+,Ni2+和__。
(2)除镍时,应调节溶液pH=__,此时Ni2+是否形成Ni(OH)2沉淀?___(是或否)。若pH过小,则产品纯度会___(升高,降低,或不变)。
(3)酸溶时,当调节pH=8时,溶液中n(Fe3+):n(Co2+)=__。
已知Ksp[Co(OH)2]=2.0×10-16,Ksp[Fe(OH)3]=4.0×10-38。
(4)除铁时先向溶液中加入30%的H2O2发生的离子反应方程式是:__。充分反应后再向溶液中加入CoCO3,调节溶液pH范围为__,使Fe3+完全转化为Fe(OH)3沉淀,最后过滤得到CoCl2溶液。
(5)已知Ag++SCN-=AgSCN↓,为测定粗产品中CoCl26H2O的含量,称取11.9g粗产品配成100mL溶液,从中取出25mL先加入含0.03mol的AgNO3,(杂质不与其反应),再用0.5mol/L的KSCN溶液标定过量的AgNO3,该标定操作所用的指示剂为__(填化学式),若消耗20.00mL的KSCN溶液,则该粗产品中CoCl26H2O的质量分数为__。
【题目】碳酸钠是重要的化工原料之一,广泛应用于轻工日化、建材、食品工业等行业。
(1)市售碳酸钠中含有氯化钠杂质,选用下列试剂设计实验方案进行检验,试剂:稀H2 SO4、BaCl2溶液、Ca(NO3)2溶液、AgNO3溶液
实验步骤 | 现 象 |
①取少量样品,加蒸馏水溶解 | ②固体完全溶解得到无色澄清溶液 |
③_____ | ④有白色沉淀生成 |
⑤静置,________ | ⑥ ________ |
(2)用AgNO3标准溶液滴定Cl-(以K2CrO4溶液为指示剂,Ag2CrO4为砖红色沉淀),来测定碳酸钠的纯度。
①配制样品溶液:称取某碳酸钠样品mg,用容量瓶配制100 mL溶液,定容时,用____加蒸馏水至刻度线。
②配制AgNO3溶液及浓度标定:称取AgNO3晶体8.5 g于烧杯中,用____取500 mL水并倒入烧杯中,搅拌摇匀后,转入____色试剂瓶,置于暗处、备用。用NaCl标准溶液标定上述AgNO3溶液浓度为b mol/L。
③滴定样品:取样品溶液20. 00 mL于锥形瓶中,加过量稀HNO3,滴入2~3滴K2 CrO4溶液,用AgNO3标准溶液滴定,滴定终点的现象为_________。
重复上述操作三次。四次测定数据如下表:
实验序号 | 1 | 2 | 3 | 4 |
消耗AgNO3溶液体积/mL | 20.00 | 21. 55 | 20. 02 | 19. 98 |
若在滴定终点读取滴定管刻度时俯视标准液液面,则测定结果____(填“偏高”、“偏低”或“无影响”);样品的纯度为____%。
【题目】298 K时,![]() γ-羟基丁酸水溶液发生如下反应,生成
γ-羟基丁酸水溶液发生如下反应,生成![]() 丁内酯: HOCH2CH2CH2COOH
丁内酯: HOCH2CH2CH2COOH![]()
![]() +H2O
+H2O
不同时刻测得![]() 丁内酯的浓度如下表。
丁内酯的浓度如下表。
| 20 | 50 | 80 | 100 | 120 | 160 | 220 | ∞ |
| 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
注:该条件下副反应、溶液体积变化忽略不计。下列分析正确的是
A.增大γ-羟基丁酸的浓度可提高γ-丁内酯的产率
B.298 K时,该反应的平衡常数为2.75
C.反应至120 min时,γ-羟基丁酸的转化率<50%
D.80~120 min的平均反应速率:v(γ-丁内酯) >1.2×10-3 mol L-1min-1
【题目】二甲醚又称甲醚,简称DME,熔点-141.5 ℃,沸点-24.9 ℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。制备原理如下:
Ⅰ.由天然气催化制备二甲醚:
①2CH4(g)+O2(g) =CH3OCH3(g)+H2O(g) ΔH1
Ⅱ.由合成气制备二甲醚:
②CO(g)+2H2(g) ![]() CH3OH(g) ΔH2=-90.7 kJ·mol-1
CH3OH(g) ΔH2=-90.7 kJ·mol-1
③2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) ΔH3
CH3OCH3(g)+H2O(g) ΔH3
回答下列问题:
(1)若甲烷和二甲醚的燃烧热分别是890.3 kJ·mol-1、1 453.0 kJ·mol-1;1 mol液态水变为气态水要吸收44.0 kJ的热量。反应③中的相关的化学键键能数据如表:
化学键 | H-H | C-O | H-O(水) | H-O(醇) | C-H |
E (kJ · mol-1) | 436 | 343 | 465 | 453 | 413 |
则ΔH1=______kJ·mol-1;ΔH3=______ kJ·mol-1
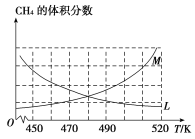
(2)反应③的化学平衡常数表达式为______________。制备原理Ⅰ中,在恒温、恒容的密闭容器中合成,将气体按n(CH4)∶n(O2)=2∶1混合,能正确反映反应①中CH4 的体积分数随温度变化的曲线是_________________。下列能表明反应①达到化学平衡状态的是_______________。
A.混合气体的密度不变
B.反应容器中二甲醚的百分含量不变
C.反应物的反应速率与生成物的反应速率之比等于化学计量数之比
D.混合气体的压强不变
(3)有人模拟制备原理Ⅱ,在500 K时的2 L的密闭容器中充入2 mol CO和6 mol H2,8 min达到平衡,平衡时CO的转化率为80%,c(CH3OCH3)=0.3 mol·L-1,用H2表示反应②的速率是__________;可逆反应③的平衡常数K3=_________。若在500 K时,测得容器中n(CH3OH)=n(CH3OCH3),此时反应③v(正)_________v(逆),说明原因____________________。