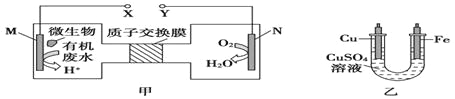
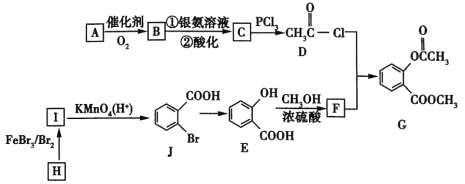
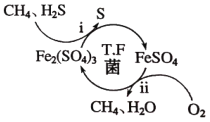
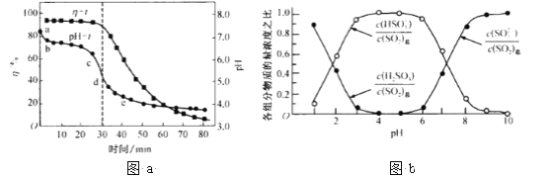
题目内容
【题目】一种免疫调节剂,其结构简式如图所示,关于该物质的说法不正确的是
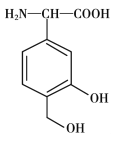
A. 属于芳香族化合物,分子式为C9H11O4N
B. 可以发生的反应类型有:加成反应、取代反应、氧化反应、聚合反应
C. 分子中所有碳原子有可能在同一平面上
D. 1mol该调节剂最多可以与3 mol NaOH反应
【答案】D
【解析】
A.将结构简式转化为分子式,含有苯环,属于芳香族化合物,分子式为C9H11O4N,A项正确,不符合题意;
B.分子中含有苯环,可以发生加成反应,分子中有—COOH、—OH可以发生酯化反应,属于取代反应,该物质可以燃烧,可以发生氧化反应,而且—CH2OH,可发生催化氧化,酚羟基也容易被氧化,分子中有氨基和羧基可以发生缩聚反应,B项正确,不符合题意;
C.根据苯分子的12原子共面以及碳碳单键可以旋转,可以判断该有机物分子中的的所有碳原子有可能共平面,C项正确,不符合题意;
D.1mol该调节剂最多可以与2 mol NaOH反应,分别是—COOH和苯环上的—OH发生反应,D项错误,符合题意;
本题答案选D。

【题目】二甲醚又称甲醚,简称DME,熔点-141.5 ℃,沸点-24.9 ℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。制备原理如下:
Ⅰ.由天然气催化制备二甲醚:
①2CH4(g)+O2(g) =CH3OCH3(g)+H2O(g) ΔH1
Ⅱ.由合成气制备二甲醚:
②CO(g)+2H2(g) ![]() CH3OH(g) ΔH2=-90.7 kJ·mol-1
CH3OH(g) ΔH2=-90.7 kJ·mol-1
③2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) ΔH3
CH3OCH3(g)+H2O(g) ΔH3
回答下列问题:
(1)若甲烷和二甲醚的燃烧热分别是890.3 kJ·mol-1、1 453.0 kJ·mol-1;1 mol液态水变为气态水要吸收44.0 kJ的热量。反应③中的相关的化学键键能数据如表:
化学键 | H-H | C-O | H-O(水) | H-O(醇) | C-H |
E (kJ · mol-1) | 436 | 343 | 465 | 453 | 413 |
则ΔH1=______kJ·mol-1;ΔH3=______ kJ·mol-1
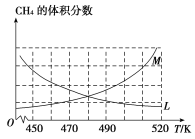
(2)反应③的化学平衡常数表达式为______________。制备原理Ⅰ中,在恒温、恒容的密闭容器中合成,将气体按n(CH4)∶n(O2)=2∶1混合,能正确反映反应①中CH4 的体积分数随温度变化的曲线是_________________。下列能表明反应①达到化学平衡状态的是_______________。
A.混合气体的密度不变
B.反应容器中二甲醚的百分含量不变
C.反应物的反应速率与生成物的反应速率之比等于化学计量数之比
D.混合气体的压强不变
(3)有人模拟制备原理Ⅱ,在500 K时的2 L的密闭容器中充入2 mol CO和6 mol H2,8 min达到平衡,平衡时CO的转化率为80%,c(CH3OCH3)=0.3 mol·L-1,用H2表示反应②的速率是__________;可逆反应③的平衡常数K3=_________。若在500 K时,测得容器中n(CH3OH)=n(CH3OCH3),此时反应③v(正)_________v(逆),说明原因____________________。
【题目】(1)为了检验和除去下表中的各种杂质(括号里的为杂质),请从①中选出适当的检验试剂,从②中选出适当的除杂试剂,将所选的答案用字母填入相应的空格内。
物质 | 检验试剂 | 除杂试剂 |
(Ⅰ)甲烷(乙烯) | ________。 | ________。 |
(Ⅱ)酒精(水) | ________。 | ________。 |
①检验试剂:
A.无水硫酸铜 B.酸性高锰酸钾溶液
C.水 D.氢氧化钠溶液
②除杂试剂:
a.无水硫酸铜 b.乙酸
c.新制的生石灰 d.溴水
除杂时,乙烯发生反应的化学方程式为____________________。
(2)如图,在左试管中先加入2 mL 95%的乙醇,并在摇动下缓缓加入3 mL浓硫酸,再加入2 mL乙酸,充分摇匀。按图连接好装置,用酒精灯对左试管小火加热3~5 min后,改用大火加热,当观察到右试管中有明显现象时停止实验。
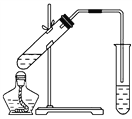
试回答:
在右试管中通常加入________溶液,实验生成的乙酸乙酯,其密度比水________,是有特殊香味的液体。分离右试管中所得乙酸乙酯的操作为(只填名称)________。反应中加入浓硫酸的作用是_____________________________________________________。