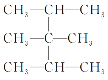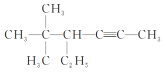ĖâÄŋÄÚČÝ
ĄūĖâÄŋĄŋÏÂÁÐĀëŨÓ·―ģĖĘ―ĘéÐīÕýČ·ĩÄĘĮ(ĄĄĄĄ)
A.ÔÚNH4Al(SO4)2ČÜŌšÖÐĩΞÓÉŲÁŋÉÕžîČÜŌšĢšAl3+ĢŦ4OH-=![]() ĢŦ2H2O
ĢŦ2H2O
B.ÔÚšŽĩČÎïÖĘĩÄÁŋÅĻķČĩÄNa2CO3šÍNaOHČÜŌšÖÐĩΞÓđýÁŋĩÄŅÎËáĢš![]() ĢŦOH-ĢŦ2H+=
ĢŦOH-ĢŦ2H+=![]() ĢŦH2O
ĢŦH2O
C.ÔÚMg(HCO3)2ČÜŌšÖÐĩΞÓđýÁŋĩÄģÎĮåĘŊŧŌËŪĢšMg2+ĢŦ2![]() ĢŦ2Ca2+ĢŦ4OH-=Mg(OH)2ĄýĢŦ2CaCO3ĄýĢŦ2H2O
ĢŦ2Ca2+ĢŦ4OH-=Mg(OH)2ĄýĢŦ2CaCO3ĄýĢŦ2H2O
D.ÔÚFe(NO3)2ÏĄČÜŌšÖÐĩΞÓÉŲÁŋNaHSO4ČÜŌšĢšFe2+ĢŦ![]() ĢŦ2H+=Fe3+ĢŦNO2ĄüĢŦH2O
ĢŦ2H+=Fe3+ĢŦNO2ĄüĢŦH2O
Ąūīð°ļĄŋC
Ąū―âÎöĄŋ
AĢŪÔÚNH4Al(SO4)2ČÜŌšÖÐĩΞÓÉŲÁŋÉÕžîČÜŌšĢŽÂÁĀëŨÓÏČ·ĒÉú·īÓĶÉúģÉĮâŅõŧŊÂÁģÁĩíĢšAl3+ĢŦ3OH-=Al(OH)3ĄýĢŽđĘAīíÎóĢŧ
BĢŪÔÚšŽĩČÎïÖĘĩÄÁŋÅĻķČĩÄNa2CO3šÍNaOHČÜŌšÖÐĩΞÓđýÁŋĩÄŅÎËáĢš![]() ĢŦOH-ĢŦ3H+=2H2O+CO2ĄüĢŽđĘBīíÎóĢŧ
ĢŦOH-ĢŦ3H+=2H2O+CO2ĄüĢŽđĘBīíÎóĢŧ
CĢŪMg(OH)2ČÜ―âķČąČMgCO3ļüÐĄĢŽÔÚMg(HCO3)2ČÜŌšÖÐĩΞÓđýÁŋĩÄģÎĮåĘŊŧŌËŪÉúģÉļüÄŅČÜĩÄMg(OH)2ĢšMg2+ĢŦ2![]() ĢŦ2Ca2+ĢŦ4OH-=Mg(OH)2ĄýĢŦ2CaCO3ĄýĢŦ2H2OĢŽđĘCÕýČ·Ģŧ
ĢŦ2Ca2+ĢŦ4OH-=Mg(OH)2ĄýĢŦ2CaCO3ĄýĢŦ2H2OĢŽđĘCÕýČ·Ģŧ
DĢŪÔÚFe(NO3)2ÏĄČÜŌšÖÐĩΞÓÉŲÁŋNaHSO4ČÜŌšÉúģÉNOĢš3Fe2+ĢŦ![]() ĢŦ4H+=3Fe3+ĢŦNOĄüĢŦ2H2OĢŽđĘDīíÎóĢŧ
ĢŦ4H+=3Fe3+ĢŦNOĄüĢŦ2H2OĢŽđĘDīíÎóĢŧ
đĘŅĄCĄĢ

ĄūĖâÄŋĄŋĖžËáÄÆĘĮÖØŌŠĩÄŧŊđĪÔÁÏÖŪŌŧĢŽđã·šÓĶÓÃÓÚĮáđĪČÕŧŊĄĒ―ĻēÄĄĒĘģÆ·đĪŌĩĩČÐÐŌĩĄĢ
(1)ĘÐĘÛĖžËáÄÆÖКŽÓÐÂČŧŊÄÆÔÓÖĘĢŽŅĄÓÃÏÂÁÐĘÔžÁÉčžÆĘĩŅé·―°ļ―øÐОėŅéĢŽĘÔžÁĢšÏĄH2 SO4ĄĒBaCl2ČÜŌšĄĒCa(NO3)2ČÜŌšĄĒAgNO3ČÜŌš
ĘĩŅéē―Öč | ÏÖ Ïó |
ĒŲČĄÉŲÁŋŅųÆ·ĢŽžÓÕôÁóËŪČÜ―â | ĒÚđĖĖåÍęČŦČÜ―âĩÃĩ―ÎÞÉŦģÎĮåČÜŌš |
ĒÛ_____ | ĒÜÓаŨÉŦģÁĩíÉúģÉ |
ĒÝūēÖÃĢŽ________ | ĒÞ ________ |
(2)ÓÃAgNO3ąęŨžČÜŌšĩÎķĻCl-(ŌÔK2CrO4ČÜŌšÎŠÖļĘūžÁĢŽAg2CrO4ΊŨĐšėÉŦģÁĩí)ĢŽĀīēâķĻĖžËáÄÆĩÄīŋķČĄĢ
ĒŲÅäÖÆŅųÆ·ČÜŌšĢšģÆČĄÄģĖžËáÄÆŅųÆ·mgĢŽÓÃČÝÁŋÆŋÅäÖÆ100 mLČÜŌšĢŽķĻČÝĘąĢŽÓÃ____žÓÕôÁóËŪÖÁŋĖķČÏߥĢ
ĒÚÅäÖÆAgNO3ČÜŌšž°ÅĻķČąęķĻĢšģÆČĄAgNO3ū§Ėå8.5 gÓÚÉÕąÖÐĢŽÓÃ____ČĄ500 mLËŪēĒĩđČëÉÕąÖÐĢŽ―Á°čŌĄÔČšóĢŽŨŠČë____ÉŦĘÔžÁÆŋĢŽÖÃÓÚ°ĩīĶĄĒąļÓÃĄĢÓÃNaCląęŨžČÜŌšąęķĻÉÏĘöAgNO3ČÜŌšÅĻķČΊb mol/LĄĢ
ĒÛĩÎķĻŅųÆ·ĢšČĄŅųÆ·ČÜŌš20. 00 mLÓÚŨķÐÎÆŋÖÐĢŽžÓđýÁŋÏĄHNO3ĢŽĩÎČë2ĄŦ3ĩÎK2 CrO4ČÜŌšĢŽÓÃAgNO3ąęŨžČÜŌšĩÎķĻĢŽĩÎķĻÖÕĩãĩÄÏÖÏóΊ_________ĄĢ
ÖØļīÉÏĘöēŲŨũČýīÎĄĢËÄīÎēâķĻĘýūÝČįÏÂąíĢš
ĘĩŅéÐōšÅ | 1 | 2 | 3 | 4 |
ÏûšÄAgNO3ČÜŌšĖåŧý/mL | 20.00 | 21. 55 | 20. 02 | 19. 98 |
ČôÔÚĩÎķĻÖÕĩãķÁČĄĩÎķĻđÜŋĖķČĘąļĐĘÓąęŨžŌšŌšÃæĢŽÔōēâķĻ―áđû____(ĖÆŦļߥąĄĒĄ°ÆŦĩÍĄąŧōĄ°ÎÞÓ°ÏėĄą)ĢŧŅųÆ·ĩÄīŋķČΊ____%ĄĢ
ĄūĖâÄŋĄŋÏōËÄÖ§ĘÔđÜÖÐ·ÖąðžÓČëÉŲÁŋēŧÍŽĩÄÎÞÉŦČÜŌš―øÐÐČįÏÂēŲŨũĢŽ―áÂÛÕýČ·ĩÄĘĮ(ĄĄĄĄ)
ŅĄÏî | ēŲŨũž°ÏÖÏó | ―áÂÛ |
A | žÓČëAgNO3ČÜŌšĢŽÉúģÉ°ŨÉŦģÁĩíĢŽÔŲžÓÏĄŅÎËáģÁĩíēŧČÜ―â | ÔČÜŌšÖÐÓÐCl-īæÔÚ |
B | ÍĻČëCl2šóĢŽČÜŌšąäΊÉîŧÆÉŦĢŽžĖÐøžÓČëĩí·ÛČÜŌššóČÜŌšąäĀķ | ÔČÜŌšÖÐÓÐI-īæÔÚ |
C | žÓČëBa(NO3)2ČÜŌšĢŽÉúģÉ°ŨÉŦģÁĩíĢŽžÓÏĄŅÎËášóģÁĩíēŧČÜ―âĘą | ÔČÜŌšÖÐÓÐ |
D | žÓČëÏĄŅÎËáĢŽÉúģÉĩÄÆøĖåÄÜĘđģÎĮåĘŊŧŌËŪąäŧëŨĮ | ÔČÜŌšÖÐÓÐ |
A.AB.BC.CD.D
ĄūĖâÄŋĄŋķþžŨÃŅÓÖģÆžŨÃŅĢŽžōģÆDMEĢŽČÛĩãĢ141.5 ĄæĢŽ·ÐĩãĢ24.9 ĄæĢŽÓëĘŊÓÍŌšŧŊÆø(LPG)ÏāËÆĢŽąŧÓþΊĄ°21ĘĀžÍĩÄĮå―āČžÁÏĄąĄĢÖÆąļÔĀíČįÏÂĢš
Ēņ.ÓÉĖėČŧÆøīßŧŊÖÆąļķþžŨÃŅĢš
ĒŲ2CH4(g)ĢŦO2(g) =CH3OCH3(g)ĢŦH2O(g)ĄĄĶĪH1
Ēō.ÓÉšÏģÉÆøÖÆąļķþžŨÃŅĢš
ĒÚCO(g)ĢŦ2H2(g) ![]() CH3OH(g) ĶĪH2Ģ―Ģ90.7 kJĄĪmolĢ1
CH3OH(g) ĶĪH2Ģ―Ģ90.7 kJĄĪmolĢ1
ĒÛ2CH3OH(g) ![]() CH3OCH3(g)ĢŦH2O(g)ĄĄĶĪH3
CH3OCH3(g)ĢŦH2O(g)ĄĄĶĪH3
ŧØīðÏÂÁÐÎĘĖâĢš
(1)ČôžŨÍéšÍķþžŨÃŅĩÄČžÉÕČČ·ÖąðĘĮ890.3 kJĄĪmolĢ1ĄĒ1 453.0 kJĄĪmolĢ1Ģŧ1 molŌšĖŽËŪąäΊÆøĖŽËŪŌŠÎüĘÕ44.0 kJĩÄČČÁŋĄĢ·īÓĶĒÛÖÐĩÄÏāđØĩÄŧŊŅ§žüžüÄÜĘýūÝČįąíĢš
ŧŊŅ§žü | HĢH | CĢO | HĢO(ËŪ) | HĢO(īž) | CĢH |
E (kJ ĄĪ molĢ1) | 436 | 343 | 465 | 453 | 413 |
ÔōĶĪH1Ģ―______kJĄĪmolĢ1ĢŧĶĪH3Ģ―______ kJĄĪmolĢ1
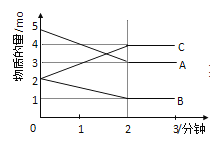
(2)·īÓĶĒÛĩÄŧŊŅ§Æ―šâģĢĘýąíīïĘ―ÎŠ______________ĄĢÖÆąļÔĀíĒņÖÐĢŽÔÚšãÎÂĄĒšãČÝĩÄÃÜąÕČÝÆũÖКÏģÉĢŽ―ŦÆøĖå°īn(CH4)ĄÃn(O2)Ģ―2ĄÃ1ŧėšÏĢŽÄÜÕýČ··īÓģ·īÓĶĒŲÖÐCH4 ĩÄĖåŧý·ÖĘýËæÎÂķČąäŧŊĩÄĮúÏßĘĮ_________________ĄĢÏÂÁÐÄÜąíÃũ·īÓĶĒŲīïĩ―ŧŊŅ§Æ―šâŨīĖŽĩÄĘĮ_______________ĄĢ
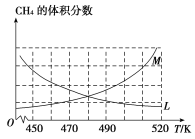
AĢŪŧėšÏÆøĖåĩÄÃÜķČēŧąä
BĢŪ·īÓĶČÝÆũÖÐķþžŨÃŅĩÄ°Ų·ÖšŽÁŋēŧąä
CĢŪ·īÓĶÎïĩÄ·īÓĶËŲÂĘÓëÉúģÉÎïĩÄ·īÓĶËŲÂĘÖŪąČĩČÓÚŧŊŅ§žÆÁŋĘýÖŪąČ
DĢŪŧėšÏÆøĖåĩÄŅđĮŋēŧąä
(3)ÓÐČËÄĢÄâÖÆąļÔĀíĒōĢŽÔÚ500 KĘąĩÄ2 LĩÄÃÜąÕČÝÆũÖÐģäČë2 mol COšÍ6 mol H2,8 minīïĩ―Æ―šâĢŽÆ―šâĘąCOĩÄŨŠŧŊÂĘΊ80%ĢŽc(CH3OCH3)Ģ―0.3 molĄĪLĢ1ĢŽÓÃH2ąíĘū·īÓĶĒÚĩÄËŲÂĘĘĮ__________ĢŧŋÉÄæ·īÓĶĒÛĩÄÆ―šâģĢĘýK3Ģ―_________ĄĢČôÔÚ500 KĘąĢŽēâĩÃČÝÆũÖÐn(CH3OH)Ģ―n(CH3OCH3)ĢŽīËĘą·īÓĶĒÛv(Õý)_________v(Äæ)ĢŽËĩÃũÔŌō____________________ĄĢ