题目内容
7.NA代表阿伏伽德罗常数,下列说法正确的是( )| A. | 3.4gNH3中含N-H键数目为0.2NA | |
| B. | 乙烯和环丙烷(C2H4)组成的28g混合气体中含有2NA个氢原子 | |
| C. | 15.6gNa2O2跟过量CO2反应时,转移电子数为0.2NA | |
| D. | 将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NA个Fe3+ |
分析 A.氨气分子中含有3个氮氢键,3.4g氨气的物质的量为0.2mol,含有0.6mol氮氢键;
B.乙烯和环丙烷最简式相同为CH2,计算28gCH2中氢原子数;
C.过氧化钠中氧元素的化合价为-1价,1mol Na2O2与二氧化碳完全反应生成0.5mol氧气,转移了1mol电子;
D.Fe3+在溶液中发生水解,Fe3+的物质的量小于0.1mol.
解答 解:A.3.4g氨气的物质的量为:$\frac{3.4g}{17g/mol}$=0.2mol,0.2mol氨气分子中含有氮氢键的物质的量为:0.2mol×3=0.6mol,含N-H键数目为0.6NA,故A错误;
B.乙烯和环丙烷最简式相同为CH2,计算42gCH2中氢原子数=$\frac{28g}{14g/mol}$×2×NA=4NA,故B错误;
C.15.6gNa2O2的物质的量为$\frac{15.6g}{78g/mol}$=0.2mol,跟过量CO2反应时,转移电子数为0.2NA,故C正确;
D.Fe3+在溶液中发生水解,Fe3+的物质的量小于0.1mol,所以溶液含有Fe3+数目小于0.1NA个,故D错误;
故选:C.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,注意盐类的水解是解题关键,题目难度不大.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
15.下列说法正确的是( )
| A. | 淀粉与纤维素互为同分异构体 | |
| B. | 汽油、柴油属于纯净物,有固定的熔沸点 | |
| C. | 利用油脂在碱性条件下的水解,可以制甘油和肥皂 | |
| D. | 蛋白质属于天然高分子化合物,盐酸可以使蛋白质变黄,称为颜色反应 |
16.下列反应属于非氧化还原反应的是( )
| A. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | B. | NH4NO3$\frac{\underline{\;△\;}}{\;}$N2O↑+2H2O | ||
| C. | 2NaHCO3$\frac{\underline{\;△\;}}{\;}$Na2CO3+CO2↑+H2O | D. | CuO+CO═Cu+CO2 |
15.电池是人类生产和生活中的重要能量来源,各式各样电池的发展是化学对人类的一项重大贡献.下列有关电池的叙述不正确的是( )
| A. | 锌锰干电池工作一段时间后锌皮变薄 | |
| B. | 铅蓄电池工作一段时间后两极板质量都增加 | |
| C. | 氢氧燃料电池将电能直接转变为化学能 | |
| D. | 银锌纽扣电池工作一段时间后有银单质生成 |
2.某结晶水合物的化学式为R•nH2O,其相对分子质量为M.25℃时,ag该晶体能够溶于bg水中形成VmL溶液,下列关系中不正确的是( )
| A. | 该溶液中溶质的质量分数为ω=$\frac{100a(M-18n)}{a+b}$% | |
| B. | 该溶液的物质的量浓度为c=$\frac{1000a}{MV}$mol•L-1 | |
| C. | 该溶液中溶剂与溶质的质量比为m(水):m(溶质)=($\frac{18na}{M}+b$):(a-$\frac{18na}{M}$) | |
| D. | 该溶液的密度为ρ=$\frac{1000(a+b)}{V}$g•L-1 |
12.某无色溶液呈强酸性,则下列各组离子一定可以大量存在的是( )
| A. | Mg2+、Al3+、HCO3-、Cl- | B. | Na+、Cu2+、Cl-、SO42- | ||
| C. | K+、NH4+、Cl-、SO42- | D. | Ba2+、Fe2+、Cl-、NO3- |
19.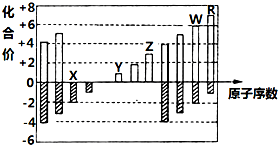 如图是部分短周期元素主要化合价与原子序数的关系图(X、Y、Z、W、R代表五种元素符号).下列说法中正确的是( )
如图是部分短周期元素主要化合价与原子序数的关系图(X、Y、Z、W、R代表五种元素符号).下列说法中正确的是( )
 如图是部分短周期元素主要化合价与原子序数的关系图(X、Y、Z、W、R代表五种元素符号).下列说法中正确的是( )
如图是部分短周期元素主要化合价与原子序数的关系图(X、Y、Z、W、R代表五种元素符号).下列说法中正确的是( )| A. | 原子半径比较:Z>Y>X | |
| B. | 最高价氧化物对应的水化物的酸性比较:W>R | |
| C. | X和Y形成的化合物中只含离子键 | |
| D. | Z的氧化物和Y的 最高价氧化物对应的水化物能反应 |
16.下列有关化学用语表示正确的是( )
| A. | 乙烯的结构简式:CH2CH2 | |
| B. | 硫原子的结构示意图: | |
| C. | 基态188O的电子排布式:1s22s22p63s23p6 | |
| D. | 过氧化钠的电子式: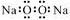 |