题目内容
12.某无色溶液呈强酸性,则下列各组离子一定可以大量存在的是( )| A. | Mg2+、Al3+、HCO3-、Cl- | B. | Na+、Cu2+、Cl-、SO42- | ||
| C. | K+、NH4+、Cl-、SO42- | D. | Ba2+、Fe2+、Cl-、NO3- |
分析 溶液无色,说明不含有色离子,如铜离子、亚铁离子等;溶液呈酸性,说明溶液中含有大量氢离子,离子之间不反应且和氢离子不反应、无色时就能大量共存,据此分析解答.
解答 解:A.H+、HCO3-发生反应生成二氧化碳、水,所以不能大量共存,故A错误;
B.Cu2+呈蓝色,不符合无色条件,故B错误;
C.这几种离子无色,离子之间不反应且和氢离子不反应,所以能大量共存,故C正确;
D.Fe2+呈浅绿色,且酸性条件下,Fe2+、NO3-发生氧化还原反应而不能大量共存,故D错误;
故选C.
点评 本题考查离子共存,为高频考点,明确离子共存条件及离子性质是解本题关键,注意题干中限制性条件“无色、酸性”,易错选项是D,题目难度不大.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
20.铅蓄电池反应为:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O.下列说法中正确的是( )
| A. | PbO2得电子,被氧化 | |
| B. | 铅蓄电池工作过程中每通过2mol电子,负极质量减少207g | |
| C. | 电流是由PbO2经外电路流向Pb | |
| D. | 电池放电时,溶液酸性增强 |
3.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | 0.1mol/L的醋酸钠溶液20mL与0.1mol/L的盐酸10mL混合后溶液显酸性c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | |
| B. | 已知酸性HF>CH3COOH,则pH相等的NaF与CH3COOK溶液中c(Na+)-c(F-)=c(K+)-c(CH3COO-) | |
| C. | 0.1mol/L的醋酸的pH=a,0.01mol/L的醋酸pH=b,则a+1=b | |
| D. | c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c(NH4Cl)<c[(NH4)2CO3]<c[(NH4)2SO4] |
7.NA代表阿伏伽德罗常数,下列说法正确的是( )
| A. | 3.4gNH3中含N-H键数目为0.2NA | |
| B. | 乙烯和环丙烷(C2H4)组成的28g混合气体中含有2NA个氢原子 | |
| C. | 15.6gNa2O2跟过量CO2反应时,转移电子数为0.2NA | |
| D. | 将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NA个Fe3+ |
1.下列溶液中有关微粒的物质的量浓度关系正确的是( )
| A. | 等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)═c(SO42-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7:c(Na+)>c(CH3COOH)═c(Cl-) | |
| C. | 物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)═2c(HCO3-)+2c(H2CO3)+2c(CO32-) | |
| D. | pH=1的NaHSO4溶液:c(H+)═2c(SO42-)+c(OH-) |
2.有机物与我们的生产生活密切相关,下列说法不正确的是( )
| A. | 葡萄糖可以发生氧化反应、银镜反应和水解反应 | |
| B. | 工业上利用油脂在碱性条件下的水解反应制取肥皂 | |
| C. | 食用植物油的主要成分是高级不饱和脂肪酸甘油酯,是人体营养物质 | |
| D. | 甲醛对人体有害,但甲醛的水溶液可用于标本的防腐 |
 ,A的一种同分异构体B,它能和Na2CO3溶液反应生成CO2,则B的结构简式为CH3COOH;A的另一种同分异构体C,在酸性条件下水解得到D和E,且D和E的相对分子质量相同,写出C发生此水解反应的化学方程式:
,A的一种同分异构体B,它能和Na2CO3溶液反应生成CO2,则B的结构简式为CH3COOH;A的另一种同分异构体C,在酸性条件下水解得到D和E,且D和E的相对分子质量相同,写出C发生此水解反应的化学方程式: .
.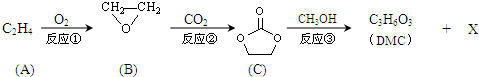
 ;XOHCH2CH2OH;
;XOHCH2CH2OH;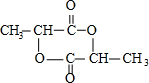 ;
;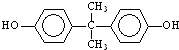 )在一定条件下可发生类似反应①的反应,生成芳香族聚碳酸酯,写出反应的化学方程式:2n
)在一定条件下可发生类似反应①的反应,生成芳香族聚碳酸酯,写出反应的化学方程式:2n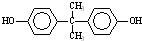 →
→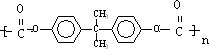 +4nCH3OH.
+4nCH3OH.