题目内容
16.下列反应属于非氧化还原反应的是( )| A. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | B. | NH4NO3$\frac{\underline{\;△\;}}{\;}$N2O↑+2H2O | ||
| C. | 2NaHCO3$\frac{\underline{\;△\;}}{\;}$Na2CO3+CO2↑+H2O | D. | CuO+CO═Cu+CO2 |
分析 氧化还原反应的特征是元素化合价的升降,可根据元素化合价的变化解答该题.
解答 解;A.Fe、C元素化合价发生变化,属于氧化还原反应,故A不选;
B.N元素化合价发生变化,属于氧化还原反应,故B不选;
C.元素化合价没有发生变化,不是氧化还原反应,故C选;
D.Cu、C元素化合价发生变化,属于氧化还原反应,故D不选.
故选C.
点评 本题考查氧化还原反应,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,难度不大.

练习册系列答案
相关题目
7.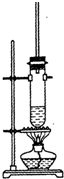 1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115-125℃,反应装置如图.下列对该实验的描述中错误的是( )
1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115-125℃,反应装置如图.下列对该实验的描述中错误的是( )
 1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115-125℃,反应装置如图.下列对该实验的描述中错误的是( )
1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115-125℃,反应装置如图.下列对该实验的描述中错误的是( )| A. | 提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤 | |
| B. | 长玻璃管起冷凝回流作用 | |
| C. | 不能用水浴加热 | |
| D. | 加入过量乙酸可以提高1一丁醇的转化率 |
4.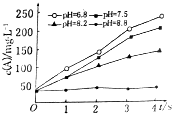 实验测得某反应在不同pH下产物A的浓度随时间变化的关系如图(其他条件不同).则下列有关说法正确的是( )
实验测得某反应在不同pH下产物A的浓度随时间变化的关系如图(其他条件不同).则下列有关说法正确的是( )
 实验测得某反应在不同pH下产物A的浓度随时间变化的关系如图(其他条件不同).则下列有关说法正确的是( )
实验测得某反应在不同pH下产物A的浓度随时间变化的关系如图(其他条件不同).则下列有关说法正确的是( )| A. | 若增大压强,该反应的反应速率一定增大 | |
| B. | pH=6.8时,随着反应的进行反应速率逐渐增大 | |
| C. | 一定pH范围内,溶液中H+浓度越小反应速率越快 | |
| D. | 可采用调节pH的方法使反应停止 |
11.3g Na在干燥的空气中与氧气反应,可得到3.5g固体,据此可判断其产物为( )
| A. | 只有Na2O2 | B. | 只有Na2O | C. | Na2O和Na2O2 | D. | 无法确定 |
3.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | 0.1mol/L的醋酸钠溶液20mL与0.1mol/L的盐酸10mL混合后溶液显酸性c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | |
| B. | 已知酸性HF>CH3COOH,则pH相等的NaF与CH3COOK溶液中c(Na+)-c(F-)=c(K+)-c(CH3COO-) | |
| C. | 0.1mol/L的醋酸的pH=a,0.01mol/L的醋酸pH=b,则a+1=b | |
| D. | c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c(NH4Cl)<c[(NH4)2CO3]<c[(NH4)2SO4] |
10.1mol某烃A能与2molHCl完全加成,其产物最多能被8molCl2完全取代,则烃A可能为( )
| A. | 丁烯 | B. | 丁炔 | C. | 丙炔 | D. | 乙炔 |
7.NA代表阿伏伽德罗常数,下列说法正确的是( )
| A. | 3.4gNH3中含N-H键数目为0.2NA | |
| B. | 乙烯和环丙烷(C2H4)组成的28g混合气体中含有2NA个氢原子 | |
| C. | 15.6gNa2O2跟过量CO2反应时,转移电子数为0.2NA | |
| D. | 将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NA个Fe3+ |
8.已知KMnO4与KNO2溶液反应的离子方程式为(未配平):MnO4-+NO2-+□-Mn2++NO3-+H2O.下列说法正确的是( )
| A. | MnO4-发生了氧化反应 | |
| B. | 氧化剂与还原剂的物质的量之比为1:3 | |
| C. | 方程式“□”中的应填入OH- | |
| D. | 氧化产物与还原产物物质的量之比是5:2 |
 .
.