题目内容
19.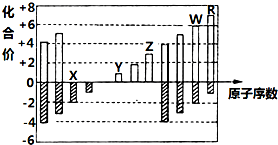 如图是部分短周期元素主要化合价与原子序数的关系图(X、Y、Z、W、R代表五种元素符号).下列说法中正确的是( )
如图是部分短周期元素主要化合价与原子序数的关系图(X、Y、Z、W、R代表五种元素符号).下列说法中正确的是( )| A. | 原子半径比较:Z>Y>X | |
| B. | 最高价氧化物对应的水化物的酸性比较:W>R | |
| C. | X和Y形成的化合物中只含离子键 | |
| D. | Z的氧化物和Y的 最高价氧化物对应的水化物能反应 |
分析 均为短周期元素,由表中化合价可知,X的化合价为-2价,没有正化合价,故X为O元素,Y的化合价为+1价,处于ⅠA族,原子序数大于O元素,故Y为Na元素,Z为+3价,为Al元素,W的化合价为+6、-2价,故W为S元素,R的最高正价为+7价,应为Cl元素,据此解答.
解答 解:均为短周期元素,由表中化合价可知,X的化合价为-2价,没有正化合价,故X为O元素,Y的化合价为+1价,处于ⅠA族,原子序数大于O元素,故Y为Na元素,Z为+3价,为Al元素,W的化合价为+6、-2价,故W为S元素,R的最高正价为+7价,应为Cl元素.
A.X为O,Y为Na,Z为Al,同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径应Na>Al>O,故A错误;
B.W为S,R为Cl,非金属性Cl>S,非金属性越强,最高价含氧酸的酸性越强,故B错误;
C.X和Y形成的化合物有氧化钠、过氧化钠,过氧化钠含有离子键、共价键,故C错误;
D.Z的氧化物为氧化铝,Y的 最高价氧化物对应的水化物为氢氧化钠,二者反应生成偏铝酸钠与水,故D正确,
故选D.
点评 本题考查结构性质与位置关系应用,难度不大,掌握化合价与族序数关系是推断元素解题的关键

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
7.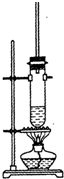 1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115-125℃,反应装置如图.下列对该实验的描述中错误的是( )
1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115-125℃,反应装置如图.下列对该实验的描述中错误的是( )
 1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115-125℃,反应装置如图.下列对该实验的描述中错误的是( )
1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115-125℃,反应装置如图.下列对该实验的描述中错误的是( )| A. | 提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤 | |
| B. | 长玻璃管起冷凝回流作用 | |
| C. | 不能用水浴加热 | |
| D. | 加入过量乙酸可以提高1一丁醇的转化率 |
10.1mol某烃A能与2molHCl完全加成,其产物最多能被8molCl2完全取代,则烃A可能为( )
| A. | 丁烯 | B. | 丁炔 | C. | 丙炔 | D. | 乙炔 |
7.NA代表阿伏伽德罗常数,下列说法正确的是( )
| A. | 3.4gNH3中含N-H键数目为0.2NA | |
| B. | 乙烯和环丙烷(C2H4)组成的28g混合气体中含有2NA个氢原子 | |
| C. | 15.6gNa2O2跟过量CO2反应时,转移电子数为0.2NA | |
| D. | 将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NA个Fe3+ |
14.下列有关溴乙烷的说法正确的是( )
| A. | 溴乙烷的电子式 | |
| B. | 向溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓ | |
| C. | 溴乙烷与KOH溶液反应:CH3CH2Br+H2O$→_{△}^{KOH}$C2H5OH+KBr | |
| D. | 用溴乙烷制取乙二醇经过以下几步:消去→加成→水解 |
11.下列物质属于同系物的是( )
| A. | CH2=CH-CH2-CH3和 | B. |  与 与 | ||
| C. | 分子组成都为 CnH2nO2 的物质 | D. | CH3CH2Cl与CH3CH2CH2Cl |
8.已知KMnO4与KNO2溶液反应的离子方程式为(未配平):MnO4-+NO2-+□-Mn2++NO3-+H2O.下列说法正确的是( )
| A. | MnO4-发生了氧化反应 | |
| B. | 氧化剂与还原剂的物质的量之比为1:3 | |
| C. | 方程式“□”中的应填入OH- | |
| D. | 氧化产物与还原产物物质的量之比是5:2 |
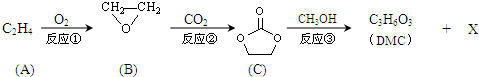
 ;XOHCH2CH2OH;
;XOHCH2CH2OH;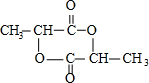 ;
;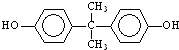 )在一定条件下可发生类似反应①的反应,生成芳香族聚碳酸酯,写出反应的化学方程式:2n
)在一定条件下可发生类似反应①的反应,生成芳香族聚碳酸酯,写出反应的化学方程式:2n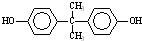 →
→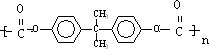 +4nCH3OH.
+4nCH3OH.