题目内容
18.在含有大量的Na+、OH-、NO3-,该溶液中还可能大量存在的离子是( )| A. | NH4+ | B. | H+ | C. | SO42- | D. | Mg2+ |
分析 根据离子之间不能结合生成沉淀、气体、水、弱电解质等,则离子大量共存,以此来解答.
解答 解:A.NH4+、OH-结合生成弱电解质,不能大量共存,故A错误;
B.H+、OH-结合生成水,不能大量共存,故B错误;
C.SO42-与溶液中的离子均不反应,可大量共存,故C正确;
D.Mg2+、OH-结合生成沉淀,不能大量共存,故D错误;
故选C.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答的关键,注意常见物质的溶解性,侧重复分解反应的离子共存考查,题目难度不大.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
8.金属锂燃料电池是一种新型电池,比锂离子电池具有更高的能量密度.它无电时也无需充电,用作燃料电池时,可更换正极的水性电解液和卡盒以及负极的金属锂就可以连续使用,分离出的氢氧化锂可采用电解其熔融物法回收锂而循环使用.其工作示意图如右图,下列说法不正确的是( )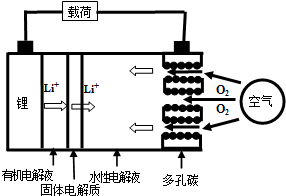

| A. | 放电时负极的电极反应式为:Li-e-=Li+ | |
| B. | 熔融的氢氧化锂用惰性电极电解再生时,金属锂在阴极得到 | |
| C. | 有机电解液可以是乙醇等无水有机物 | |
| D. | 放电时,正极的电极反应式为:2H2O+O2+4e-=4OH- |
9.下列有机反应的方程式书写错误的是( )
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | B. | CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH | ||
| C. |  +HNO3$→_{50-60℃}^{浓硫酸}$ +HNO3$→_{50-60℃}^{浓硫酸}$ +H2O +H2O | D. | nCH2=CH2$\stackrel{一定条件}{→}$ |
3.配制一定物质的量浓度的KOH溶液时,导致所配溶液浓度偏低的原因可能是( )
| A. | 定容时俯视 | B. | 容量瓶中原有少量的蒸馏水 | ||
| C. | 容量瓶盛过KOH溶液,使用前未洗涤 | D. | 转移时,不慎将液体流到瓶外 |
7.下列有关图象说法正确的是( )
| A. | 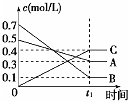 表示反应的方程式为5A(g)+7B(g)?4C(g) | |
| B. | 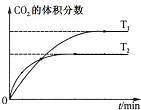 表示反应5CO(g)+I2O5(s)?5CO2(g)+I2(s)△H<0 | |
| C. | 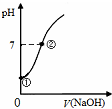 表示向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液的pH 变化,①到②水的电离程度逐渐减小 | |
| D. | 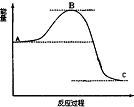 表示4H2(g)+2NO2(g)=N2(g)+4H2O(g)反应过程的能量变化,加入催化剂,将使C 点降低 |
8.下列关于化学键的说法正确的是( )
| A. | 由非金属元素组成的化合物不一定是共价化合物 | |
| B. | 非极性键只存在于双原子分子中 | |
| C. | 构成单质分子的微粒一定含有共价键 | |
| D. | 不同元素组成的多原子分子里的化学键一定是极性键 |
 某同学进行如下实验,探究化学反应中的能量变化.通过实验测出,反应前后①烧杯中的温度升高,②烧杯中的温度降低.
某同学进行如下实验,探究化学反应中的能量变化.通过实验测出,反应前后①烧杯中的温度升高,②烧杯中的温度降低.