题目内容
6. 有A、B、C、D、E、F、G、H八种原子序数依次增大的元素(原子序数均小于30).A原子的核外电子数与电子层数相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,A、E同主族,F的基态原子s能级的电子总数与p能级的电子数相等,B、G同族,H的基态原子的3d轨道电子数是4s电子数的4倍.请回答下列问题:
有A、B、C、D、E、F、G、H八种原子序数依次增大的元素(原子序数均小于30).A原子的核外电子数与电子层数相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,A、E同主族,F的基态原子s能级的电子总数与p能级的电子数相等,B、G同族,H的基态原子的3d轨道电子数是4s电子数的4倍.请回答下列问题:(1)H元素在周期表中属于d区.G的基态原子电子排布式为1s22s22p63s23p2CD2-中C的杂化类型是sp2
(2)下列说法不正确的是bcd.
a.B2A2分子中含有σ键和π键
b.A2D2分子的空间构型为直线形
c.B、C、D的第一电离能由大到小的顺序为D>C>B
d.H2+能与BD分子形成[H(BD)4]2+,其原因是BD分子中含有空轨道
e.B和G的单质能形成相同类型的晶体,其熔点B>G
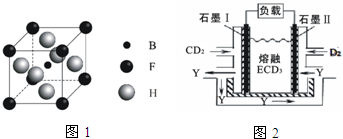
(3)由B、F、H三种元素形成的一种具有超导性的晶体,B位于F和H原子紧密堆积所形成的空隙当中.晶胞如图1所示,该晶体的化学式为MgNi3C
(4)已知化合物甲由A、B、D元素形成的最简单的醇类,实验测得,5g甲在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出表示甲燃烧热的热化学方程式:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.4kJ/mol
(5)CD2、D2和熔融ECD3可制作燃料电池,其原理如图2所示.该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,石墨Ⅰ电极反应式为NO2-e-+NO3-=N2O.
分析 A、B、C、D、E、F、G、H八种元素的原子序数依次增大,B的基态原子有3个不同的能级,且各能级中的电子数相等,原子核外电子排布式为1s22s22p2,故B为C元素;B、G同族,则G为Si元素;
H的基态原子的3d轨道电子数是4s电子数的4倍,4s电子只能有2个电子层,故原子核外电子排布为1s22s22p63s23p63d84s2,故H为Ni;
F的基态原子的s能级的电子总数与p能级的电子数相等,原子核外电子排布式为1s22s22p4或1s22s22p63s2;D的基态原子与B的基态原子的未成对电子数目相同,D的原子序数小于E,原子核外电子排布只能为1s22s22p4,则D为O元素、故F为Mg;
C的原子序数介于碳、氧之间,则C为N元素;
A原子的核外电子数与电子层数相等,其原子序数在8种元素中最小,则A为H或Be元素,又A、E同主族,则A只能为H元素、E为Na元素,以此解答该题.
解答 解:A、B、C、D、E、F、G、H八种元素的原子序数依次增大,B的基态原子有3个不同的能级,且各能级中的电子数相等,原子核外电子排布式为1s22s22p2,故B为C元素;B、G同族,则G为Si元素;H的基态原子的3d轨道电子数是4s电子数的4倍,4s电子只能有2个电子层,故原子核外电子排布为1s22s22p63s23p63d84s2,故H为Ni;F的基态原子的s能级的电子总数与p能级的电子数相等,原子核外电子排布式为1s22s22p4或1s22s22p63s2;D的基态原子与B的基态原子的未成对电子数目相同,D的原子序数小于E,原子核外电子排布只能为1s22s22p4,则D为O元素、故F为Mg;C的原子序数介于碳、氧之间,则C为N元素;A原子的核外电子数与电子层数相等,其原子序数在8种元素中最小,则A为H或Be元素,又A、E同主族,则A只能为H元素、E为Na元素,
(1)H为Ni元素,Ni的基态原子的核外电子排布为1s22s22p63s23p63d84s2,在周期表中属于d区;G为Si元素,其原子核外电子总数为14,其基态原子电子排布式为:1s22s22p63s23p2;CD2+为NO2+,NO2-中N原子形成2δ键,孤对电子数为$\frac{5+1-2×2}{2}$=1,则价层电子对个数是3,所以中心原子N原子采取sp2杂化,
故答案为:d;1s22s22p63s23p2;sp2;
(2)a.B2A2分子为C2H2,乙炔分子中中含有1个σ键和2个π键,故a正确;
b.A2D2分子为H2O2,双氧水分子是每个氧原子含有2个共用电子对且含有2个孤电子对,所以其价层电子对数是4,氧原子采用sp3杂化,所以其空间构型为V型,故b
错误;
c.N、O三种元素,C、N、O同周期,随原子序数增大的第一电离能呈增大趋势,但N元素2p能级容纳3个电子,处于半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能由小到大的顺序为C<O<N,故c错误;
d.H2+为Ni2+,BD为CO,由于Ni2+含有空轨道,所以二者能够形成[Ni(CO)]2+,故d错误;
e.B和G的单质分别为金刚石、Si,二者形成的晶体为原子晶体,晶体类型相同,由于共价键碳碳键较短,则沸点:C>Si,故g正确;
故答案为:bcd;
(3)B为C、F为Mg、H为Ni元素,由晶胞晶胞可知,晶胞中C原子数目=1、Ni元素数目=6×$\frac{1}{2}$=3、Mg原子数目=8×$\frac{1}{8}$=1,故该晶体的化学式为:MgNi3C,
故答案为:MgNi3C;
(4)化合物甲由A、B、D元素形成的最简单的醇类,为CH3OH,5g甲在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,甲醇的物质的量为$\frac{5g}{32g/mol}$,则1mol甲醇放出的热量为$\frac{113.5kJ}{\frac{5}{32}}$=726.4kJ,
热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.4kJ/mol,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.4kJ/mol;
(5)NO2、O2和熔融NaNO3可制作燃料电池,根据图示可知,通O2一极为正极,电极反应式为O2+2N2O5+4e-=4NO3-;通NO2一极为负极,电极反应为:NO2+NO3--e-=N2O5,则电池总反应为:4NO2+O2=2N2O5,
故答案为:NO2-e-+NO3-=N2O.
点评 本题考查位置、结构与性质关系的综合应用,为高考常见题型,题目难度中等,正确推断各元素名称为解答关键,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力,注意熟练掌握原子结构与元素周期表结构、元素周期律内容的关系.

元素推断题:
X、Y、Z、W为四种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如下图所示:
X | Y |
|
| Z | W |
请回答下列问题:
(1)W位于周期表中第 周期,第 族。
(2)X可形成双原子分子,其分子的电子式是 ;Y和氢元素形成的10电子微粒中常见的+1价阳离子为 (填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子为 。
(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式 。
(4)在一定条件下,由元素Y和Z组成的一种气态化合物可发生催化氧化反应,反应达平衡进有三种气态物质共存,已知每转移4mol电子放热190.0kJ,该反应的热化学方程式为 。
| A. | PM2.5(直径小于或者等于2.5×10-6m的细颗粒物)分散在空气中形成的溶胶 | |
| B. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| C. | 自来水厂可使用Cl2和绿矾(FeSO4•7H2O) 进行自来水的消毒、净化,以改善水质 | |
| D. | 在食品包装袋中放入装有硅胶的透气小袋,可以防止食物氧化变质 |
| A. | 在Na2SO4溶液中滴入Ba(OH)2溶液,产生白色沉淀:Ba2++SO42-=BaSO4↓ | |
| B. | 向H2O中加入少量Na2O2,产生无色气体:2Na2O2+2H2O=O2↑+4OH-+4Na+ | |
| C. | 向Cl2水中滴入适量Fe(NO3)2 溶液,溶液变为黄色:2Fe2++Cl2=2Fe3++2Cl- | |
| D. | 向淀粉KI溶液中滴加酸性H2O2溶液,溶液变蓝色:H2O2+2I-+2H+=I2+2H2O |
| A. | 微粒半径:Cl->K+>Al3+>O2- | B. | 碱性:KOH>Ca(OH)2>Mg(OH)2 | ||
| C. | 晶体熔点:金刚石>氯化镁>汞>碘 | D. | 稳定性和还原性:H2O>H2S>AsH3 |
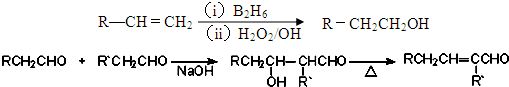
 、
、 ;
;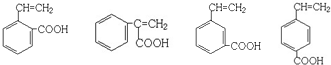 .
.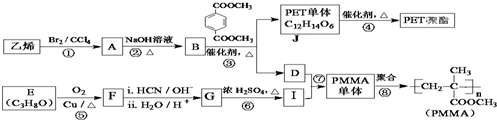
 $→_{ii.H_{2}O/H+}^{i.HCN/OH-}$
$→_{ii.H_{2}O/H+}^{i.HCN/OH-}$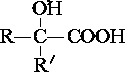 (R、R′代表烃基)
(R、R′代表烃基) $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +2H2O.
+2H2O.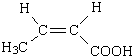 .
. 、
、 、
、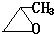 .
.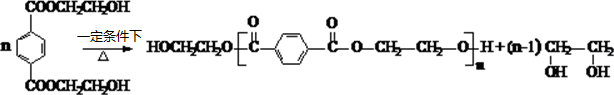 .
. )所示,回答下列问题.
)所示,回答下列问题.
 .
.