题目内容
20.NA代表阿伏加德罗常数,有关说法正确的是( )| A. | 常温常压下,11.2L乙烯所含分子数目小于0.5NA | |
| B. | 常温常压下,28g乙烯和丙烯的混合气体中所含碳原子数目小于NA | |
| C. | 乙炔的摩尔质量为26g | |
| D. | 标准状态下,将22.4L乙醇溶于水后配成500mL溶液,所得溶液物质的量浓度为2 mol/L |
分析 A.常温常压Vm>22.4L/mol;
B.乙烯和丙烯的最简式相同,碳的质量分数相同,计算碳元素的质量,再计算碳原子数目;
C.g为质量单位;
D.乙醇标况下为液体.
解答 解:A.常温常压Vm>22.4L/mol,所以11.2L乙烯物质的量小于0.5mol,含分子数目小于0.5NA,故A正确;
B.2.8g乙烯和丙烯的混合气体中碳元素的质量为28g×$\frac{12}{14}$=24g,所含碳原子数目为$\frac{2.4g}{12g/mol}$×NAmol-1=2NA,故B错误;
C.乙炔的摩尔质量为26g/mol,故C错误;
D.乙醇标况下为液体,不能使用气体摩尔体积,故D错误;
故选:A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,注意气体摩尔体积适用的对象和条件,题目难度不大.

练习册系列答案
相关题目
8.某物质结构如图.下列有关该物质的说法正确的是( )
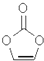

| A. | 分子式为C3H4O3 | B. | 分子中含8个σ键 | ||
| C. | 分子中只有极性键 | D. | 8.6g该物质完全燃烧得到6.72LCO2 |
15.已知某温度下,重水D2O的离子积为1.6×10-15,可以用pH一样的定义来规定pD=-lg(D+),以下关于pD的叙述正确的是( )
| A. | 该温度下纯重水的pD=7 | |
| B. | 在1L D2O的溶液中溶解0.01mol NaOD(设溶液体积为1L),其中pD=12 | |
| C. | 向100mL 0.25mol•L-1的DCl重水溶液中加入50mL 0.2mol•L-1的NaOD的重水溶液,其中pD=2 | |
| D. | 在1L D2O中溶解0.01mol DCl(设溶液的体积为1L),其中pD=2 |
5.等体积混合0.1mol•L-1的盐酸和0.06mol•L-1的Ba(OH )2溶液,不考虑体积效应,即认为混合溶液的体积等于进行混合的两溶液体积之和,溶液的pH值等于( )
| A. | 2.0 | B. | 12.3 | C. | 1.7 | D. | 12.0 |
12.四种短周期元素在周期表中的位置如图,其中X元素的原子最外层电子数等于其电子层数.下列说法不正确的是( )
| Z | W | ||
| X | Y |
| A. | X元素最高价氧化物化学式为X2O3 | |
| B. | 原子半径:X>Y>Z>W | |
| C. | 最简单气态氢化物的热稳定性:W>Y | |
| D. | Y元素的最高价氧化物既能与NaOH溶液反应,也能与HF溶液反应,属于两性氧化物 |
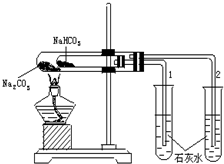 实验室利用如图所示装置进行Na2CO3和NaHCO3热稳定性对比实验.请回答:
实验室利用如图所示装置进行Na2CO3和NaHCO3热稳定性对比实验.请回答: 为原料(其它无机试剂任选),合成
为原料(其它无机试剂任选),合成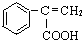 的流程图如下.请回答:
的流程图如下.请回答: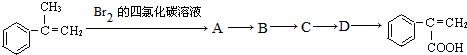
 ;
; .
.