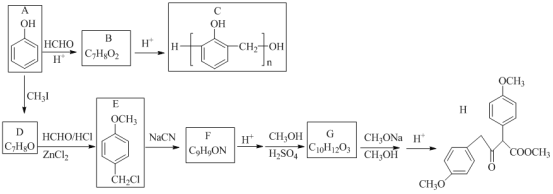
题目内容
【题目】(1)一定条件下的密闭容器中,反应3H2(g)+3CO(g)![]() CH3OCH3(二甲醚)(g)+CO2(g) ΔH<0达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。
CH3OCH3(二甲醚)(g)+CO2(g) ΔH<0达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。
a.升高温度b.加入催化剂 c.减小CO2的浓度d.增加CO的浓度 e.分离出二甲醚
(2)已知反应②2CH3OH(g)![]() CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
①比较此时正、逆反应速率的大小:v(正) v(逆)(填“>”“<”或“=”)。
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)= ;该时间内反应速率v(CH3OH)= 。
【答案】 (1)c、e (2)①> ②0.04 mol·L-1 0.16 mol·(L·min)-1
【解析】
试题 (1)正反应是放热反应,升高温度平衡左移,CO转化率减小;加入催化剂,平衡不移动,转化率不变;减少CO2的浓度、分离出二甲醚,平衡右移,CO转化率增大;增大CO浓度,平衡右移,但CO转化率降低,故选c、e。
(2)此时的浓度商Qc==1.86<400,反应未达到平衡状态,向正反应方向移动,故v(正)>v(逆);设平衡时生成物的浓度为(0.6 mol·L-1+x),则甲醇的浓度为(0.44 mol·L-1-2x),根据平衡常数表达式400=,解得x=0.2 mol·L-1,故0.44 mol·L-1-2x=0.04 mol·L-1。
由表可知,甲醇的起始浓度为(0.44+1.2) mol·L-1=1.64 mol·L-1,其平衡浓度为0.04 mol·L-1,10 min内变化的浓度为1.6 mol·L-1,故v(CH3OH)=0.16 mol·(L·min)-1。