题目内容
【题目】已知2SO2(g)+O2(g)![]() 2SO3(g) ΔH =-197 kJ·mol-1。在25 ℃时,向恒压密闭容器中通入2 mol SO2和1 mol O2,达到平衡时放出热量a1;若25 ℃时,在此恒压密闭容器中只通入1 mol SO2和0.5 mol O2,达到平衡时放出热量a2。则下列关系正确的是( )
2SO3(g) ΔH =-197 kJ·mol-1。在25 ℃时,向恒压密闭容器中通入2 mol SO2和1 mol O2,达到平衡时放出热量a1;若25 ℃时,在此恒压密闭容器中只通入1 mol SO2和0.5 mol O2,达到平衡时放出热量a2。则下列关系正确的是( )
A. 2a2=a1=197 kJ B. 2a2<a1<197 kJ
C. a2>a1>197 kJ D. 197 kJ>a1=2a2
【答案】D
【解析】
恒温恒压下,同一可逆反应,若投料量转化成相同物质时量是成比例的,达平衡时即为等效平衡,平衡后体系中各组分的百分含量相同,各组分的浓度相同;所以题中两个反应为等效平衡,达到平衡时反应物的转化率相等,则反应放出的热量关系为:a1=2a2;再根据可逆反应特点得出:197kJ>a1=2a2.
恒温恒压下,对于可逆反应2SO2(g)+O2(g)![]() 2SO3(g),向恒压密闭容器中通入2molSO2和1mol O2与只通入1molSO2和0.5molO2互为等效平衡,达到平衡时反应物的转化率一定相等,则反应放出的热量关系为:a1=2a2;
2SO3(g),向恒压密闭容器中通入2molSO2和1mol O2与只通入1molSO2和0.5molO2互为等效平衡,达到平衡时反应物的转化率一定相等,则反应放出的热量关系为:a1=2a2;
在可逆反应的热化学方程式中,反应热是指完全转化的反应热,所以a1<197kJ,
即:197kJ>a1=2a2,
故选:D。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案【题目】根据下列实验操作和现象所得出的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 向盛有少量苯酚稀溶液的试管中逐滴加入饱和溴水,产生白色沉淀 | 苯酚与Br2反应生成2,4,6三溴苯酚 |
B | 向H2O2溶液中滴入NaClO溶液,产生无色气体 | H2O2具有氧化性 |
C | 向FeCl3溶液中滴入少量KI溶液,再加入KSCN溶液,溶液变红 | Fe3+与I-的反应具有可逆性 |
D | 向蔗糖中滴加少量浓硫酸,搅拌,蔗糖变黑,体积膨松,变成疏松多孔的海绵状 | 浓硫酸具有脱水性和氧化性 |
A. AB. BC. CD. D
【题目】水体砷污染已成为一个亟待解决的全球性环境问题,我国科学家研究零价铁活化过硫酸钠(Na2S2O8)去除废水中的正五价砷[As(Ⅴ)],其机制模型如下。
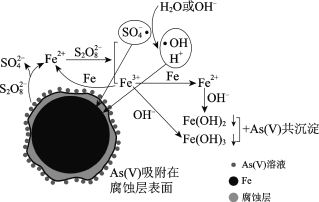
零价铁活化过硫酸钠去除废水中As(Ⅴ)的机制模型
资料:
Ⅰ.酸性条件下SO4·为主要的自由基,中性及弱碱性条件下SO4·和·OH同时存在,强碱性条件下·OH为主要的自由基。
Ⅱ.Fe2+、Fe3+形成氢氧化物沉淀的pH
离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe2+ | 7.04 | 9.08 |
Fe3+ | 1.87 | 3.27 |
(1)砷与磷在元素周期表中位于同一主族,其原子比磷多一个电子层。
① 砷在元素周期表中的位置是______。
② 砷酸的化学式是______,其酸性比H3PO4______(填“强”或“弱”)。
(2)零价铁与过硫酸钠反应,可持续释放Fe2+,Fe2+与S2O82反应生成Fe3+和自由基,自由基具有强氧化性,利于形成Fe2+和Fe3+,以确保As(Ⅴ)去除完全。
①S2O82中S的化合价是______。
②零价铁与过硫酸钠反应的离子方程式是______。
③Fe3+转化为Fe2+的离子方程式是______。
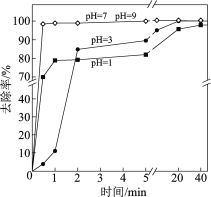
(3)不同pH对As(Ⅴ)去除率的影响如图。5 min内pH = 7和pH = 9时去除率高的原因是______。