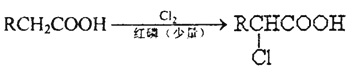��Ŀ����
����Ŀ�������������һ��dz����ɫ���壬�׳�Ħ���Σ��仯ѧʽΪ:FeSO4��(NH4)2SO4��6H2O�����������ڿ������ױ����������γ�Ħ���κ���ȶ��ˡ���������刺�����������������淋����ʵ�������Ƶá���ͼ��ģ�ҵ�Ʊ���������茶����ʵ��װ�á��ش���������:
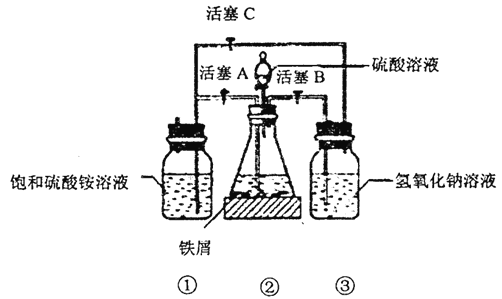
I.(1)����30%������������Һ��з���м(���������ۡ����⡢FeS ��)��������ˮϴ����������������Һ��е�Ŀ����__________________��
(2)�������õ���м������ƿ�У�����ϡ���ᡣ��ƿ�з�����Ӧ�����ӷ���ʽ����Ϊ________(�����)��
A.Fe+2H+==Fe2++H2�� B.Fe2O3+5H+===2Fe3++3H2O
C.2Fe3++S2-==2Fe2++S�� D.2Fe3++Fe==3Fe2+
(3)���������ڵķ�Ӧ������������ͨ��������Ӧ�رջ���_______������______(����ĸ)����������NaOH��Һ��������___________������������ͨ��������Ŀ����___________��
I.����ƿ�е���м�췴Ӧ��ʱ���رջ���B��C������A�����������������Ὣ��ƿ�е���������(�����ٲ���δ��Ӧ��ϡ����)ѹ�������������Һ�ĵײ����ڳ����·���һ��ʱ�䣬�Լ�ƿ�ײ����ᾧ����������李��Ƶõ���������茶������������м�������Fe2+��Ϊ�ⶨ������Fe2+�ĺ�������ȡһ������Ϊ20.0g ����������茶�����Ʒ���Ƴ���Һ����0.5 mol/LKMnO4��Һ�ζ�������Һ��Fe2+ȫ����������MnO4- ����ԭ��Mn2+ʱ����KMnO4 ��Һ���20.00mL��
�ζ�ʱ����KMnO4 ��Һװ��____(��ʽ���ʽ) �ζ����У��жϷ�Ӧ����ζ��յ������Ϊ____��������FeSO4����������Ϊ____________��
���𰸡� ȥ����м��������ۣ���ʹ���۷���ˮ�⣩ A��B��D A BC ϴ�ӳ�ȥ��������H2S �����������Һ�е��ܽ�O2��������Һ���ϲ���O2(����Fe2+������) ��ʽ ����Һ����Ϻ�ɫ��30s�ڲ���ɫ 38%
��������I. (1)�����ڼ���������ˮ������ף�����������������Һ��е�Ŀ����ȥ����м�����������
(2)����м�е�����(Fe2O3)��FeS������ϡ���ᷴӦ�����Է�����Ӧ�����ӷ���ʽ����Fe2O3+ 5H+ = 2Fe3++3H2O��2Fe3++Fe==3Fe2+��Fe+2H+==Fe2++H2����FeS+2H+=Fe2+ +H2S����2Fe3++ H2S=2Fe2++S��+2H+�������ȷ��ΪA��B��D��
(3)����װ��ͼ�������乤��ԭ���ɵã�Ҫ���������в���������ͨ���������У�Ӧ�رջ���A������B��C����������NaOH��Һ��������������Ʒ�е�������ϡ���ᷴӦ������H2S����������������ͨ��������Ŀ�����ų������е���������ֹ���������������������
II. KMnO4��Һ����ǿ�������ԣ��ܹ���ʴ������KMnO4��ҺӦװ����ʽ�ζ��������ζ��յ�������ǵ��μ����һ��KMnO4��Һʱ����Һ��ɫ����Ϻ�ɫ��30s�ڲ���ɫ����֪KMnO4��Fe2+��Ӧ�����ӷ���ʽΪMnO4- +5Fe2+ + 8H+ = 5Fe3+ + Mn2++4H2O��ʵ������n(KMnO4)= 0.5mol/L��0.02L=0.01mol����FeSO4����������=![]() ��100% =38%��
��100% =38%��

 �����Ļ���������人������ϵ�д�
�����Ļ���������人������ϵ�д� ���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д�
���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д� ��ٽ������½������������ϵ�д�
��ٽ������½������������ϵ�д�����Ŀ���������ƣ�NaClO2����һ����Ҫ��ɱ����������ͬʱҲ�Ƕ����������������������ռ���
�����������ƣ�NaClO3��Ϊԭ���Ʊ�NaClO2��Ʒ�Ĺ�����������ͼ��ʾ��

��֪��
i.��ClO2�ֽⱬը��������ClO2�����������10%���±Ƚϰ�ȫ��
ii.NaClO2�ڼ�����Һ���ȶ����ڣ���������Һ��Ѹ�ٷֽ⣻
iii.NaClO2������Һ���¶ȵ���38��ʱ����NaClO23H2O�����ڻ����38��ʱ����NaClO2���壬����60��ʱ�ֽ��NaClO3��NaCl��
��1���Լ�AӦѡ��_________��������ĸ��
a��SO2 b��Ũ���� c��KMnO4
��2����Ӧ�������ӷ���ʽΪ_________��
��3����֪ѹǿԽ�����ʵķе�Խ�ߡ���Ӧ����������á���ѹ������������ԭ����________��
��4�����й����������̵�˵���У���������_________��������ĸ��
a����Ӧ�����й�����Ӧ�����������
b����Ӧ����õ���ĸҺ�У����ʵ���Ҫ�ɷ���NaCl
c����Ӧ����NaOH��ҺӦ����
d����ȴ�ᾧʱ�¶�ѡ��38�������˺������ˮϴ�ӣ�Ȼ���ڵ���60���½��и���õ��ֲ�ƷNaClO2
��������NaClO2��Һ��Ϊ���ռ���ͬʱ��������������������
��5���ڹ��ݷ�Ӧ����ͨ�뺬��SO2��NO����������Ӧ�¶�Ϊ323 K��NaClO2��ҺŨ��Ϊ5��103mol/L����Ӧһ��ʱ�����Һ������Ũ�ȵķ���������±���
���� | SO42 | SO32 | NO3 | NO2 | Cl |
c /��mol/L�� | 8.35��104 | 6.87��106 | 1.5��104 | 1.2��105 | 3.4��103 |
��д��NaClO2��Һ������������Ҫ��Ӧ�����ӷ���ʽ_________��
����ʵ������֪������Ӧ����_________������ڡ���С�ڡ���������Ӧ���ʡ���SO2��NO�������еij�ʼŨ�Ȳ�ͬ�⣬�����ܴ��ڵ�ԭ����_________��������������ɣ�