题目内容
【题目】在化学反应中,只有极少数分子的能量比所有分子的平均能量高得多,只有这些高能量的分子发生碰撞时才可能发生化学反应,人们把这些高能量的分子称为活化分子,其他分子成为普通分子.把活化分子的平均能量与反应物分子的平均能量之间的差值叫活化能,单位为kJ/mol.请认真观察如图后回答问题. 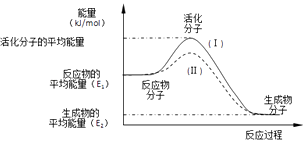
(1)图中所示的反应是(填“吸热”或“放热”)反应,该反应的△H=kJ/mol(用含E1、E2的代数式表示).
(2)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能明显降低,活化分子百分数增多,反应速率加快,你认为最有可能的原因是 .
(3)0.01mol甲苯(分子式为C7H8 , 常温下为液态)在足量的O2中燃烧,生成CO2气体和液态水,放出39.43kJ的热量.该反应的热化学方程式为: .
(4)将煤转化为水煤气(CO和H2的混合气体)是通过化学方法将煤转化为洁净燃料的方法之一.煤转化为水煤气的主要化学反应为:C(s)+H2O(g)═CO(g)+H2(g);焓变为△H1 . 已知:①2H2(g)+O2(g)═2H2O(g);△H2=﹣483.6kJ/mol
②2C(s)+O2(g)═2CO(g);△H3=﹣221.0kJ/mol结合上述热化学方程式计算得出△H1=kJ/mol
(5)计算△H1时所用到的基本化学规律叫做定律.
【答案】
(1)放热; E2﹣E1
(2)使用了催化剂
(3)C7H8(l)+9O2(g)=7CO2(g)+4H2O(l)△H=﹣3943 kJ/mol
(4)+131.3
(5)盖斯
【解析】解:(1)依据图象分析反应物的能量大于生成物的能量,反应放热;反应的焓变=生成物的能量﹣反应物的能量,即△H=(E2﹣E1)kJmol﹣1,
所以答案是:放热;E2﹣E1;(2)对于同一反应,图中虚线( II)与实线( I)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,说明反应的活化能降低焓变不变,平衡不动,化学反应速率影响因素中,催化剂有此作用,所以最有可能使用了催化剂,
所以答案是:使用了催化剂;(3)0.01mol甲苯(分子式为C7H8,常温下为液态)在足量的O2中燃烧,生成CO2气体和液态水,放出39.43kJ的热量,1mol甲苯(分子式为C7H8,常温下为液态)在足量的O2中燃烧,生成CO2气体和液态水,放出3943kJ的热量,则热化学方程式为:C7H8(l)+9O2(g)=7CO2(g)+4H2O(l)△H=﹣3943 kJ/mol,
所以答案是:C7H8(l)+9O2(g)=7CO2(g)+4H2O(l)△H=﹣3943 kJ/mol;(4)已知:①2H2(g)+O2(g)=2H2O(g);△H2=﹣483.6kJmol﹣1
②2C(s)+O2(g)=2CO(g);△H3=﹣221.0kJmol﹣1
为求C(s)+H2O(g)=CO(g)+H2(g);△H1的反应热,可用盖斯定律将 ![]() 可得:
可得:
△H1= ![]() =+131.3kJ/mol,
=+131.3kJ/mol,
所以答案是:+131.3;(5)计算△H1时,将 ![]() 可得△H1,其热效应总是相同的,为盖斯定律,所以答案是:盖斯.
可得△H1,其热效应总是相同的,为盖斯定律,所以答案是:盖斯.
【考点精析】解答此题的关键在于理解反应热和焓变的相关知识,掌握在化学反应中放出或吸收的热量,通常叫反应热.

【题目】化学反应的快慢和限度对人类生产、生活有重要的意义。
(1)将影响化学反应速率的因素镇在空格处。
实例 | 影响因素 |
食物放在冰箱里延长保质期 | ①___ |
实验室将块状药品研细,再进行反应 | ②___ |
(2)某小组将酸性KMnO4溶液与H2C2O4(具有还原性)溶液混合,用反应中溶液紫色消失快慢的方法研究形响化学反应速率的因素。实验中酸性KMnO4溶液(0.0010mol/L)、H2C2O4溶液的用量均为4mL(忽略加入固体,溶液混合时体积的变化)。
①该反应中氧化剂与还原剂的物质的量之比为________。
②请帮助他们完成以下实验设计表:填写IV中的数据,并将实验目的补充完整。
实验编号 | 温度/K | 催化剂的用量/g | H2C2O4溶液的浓度/mol.L-1 | 实验目的 |
I | 298 | 0.5 | 0.010 | A.实验I和II探究____对反应速率的影响 B.实验I和III探究____对反应速率的影响 C.实验I和IV探究催化剂对反应速率的影响 |
II | 298 | 0.5 | 0.050 | |
III | 323 | 0.5 | 0.010 | |
IV | ____ | ____ | ____ |
③该小组同学对实验II进行了3次实验,测得以下数据:
实验编号 | 溶液退色所需时问t/min | ||
第1次 | 第2次 | 第3次 | |
II | 4.9 | 5.1 | 5.0 |
实验II中用KMnO4表示该反应的平均反应速率为____。