题目内容
18.下列金属冶炼的方法错误的是( )| A. | 加热分解Ag2O冶炼银 | B. | 用CO还原氧化铁冶炼铁 | ||
| C. | 钠与Mg2Cl溶液反应冶炼镁 | D. | 电解熔融氧化铝冶炼铝 |
分析 依据金属的活泼性,金属的冶炼方法有:
电解法:冶炼活泼金属K、Ca、Na、Mg、Al,一般用电解熔融的氯化物(Al是电解熔融的三氧化二铝)制得;
热还原法:冶炼较不活泼的金属Zn、Fe、Sn、Pb、Cu,常用还原剂有(C、CO、H2等);
热分解法:Hg、Ag用加热分解氧化物的方法制得;据此解答.
解答 解:A.银为不活泼金属,可用热分解氧化物方法制取,故A正确;
B.铁较不活泼,常用热还原法制取,故B正确;
C.钠与盐溶液反应先与水反应,不能制取镁,镁性质活泼,用电解熔融氯化镁的方法制取,故C错误;
D.铝性质活泼,用电解熔融氧化铝的方法制取,故D正确;
故选:C.
点评 本题考查了金属的冶炼方法,熟悉金属的活泼性及冶炼方法是解题关键,题难度不大.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
6.下列有机物中,沸点最高的是( )
| A. | 乙醇 | B. | 乙烯 | C. | 乙烷 | D. | 丙烷 |
13.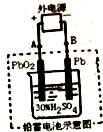 铅蓄电池是可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O,下列说法正确的是( )
铅蓄电池是可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O,下列说法正确的是( )
 铅蓄电池是可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O,下列说法正确的是( )
铅蓄电池是可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O,下列说法正确的是( )| A. | 放电时,电解质溶液中H2SO4的浓度将变大 | |
| B. | 放电时,正极反应式为:Pb+SO42--2e-=PbSO4 | |
| C. | 放电后用如图所示装置充电,电解质溶液中H+移向左边(PbO2极) | |
| D. | 用如图所示装置充电,阳极反应式为:PbSO4+2H2O-2e-=PbO2+SO42-+4H+ |
3.100mL浓度为2mol•L-1的硫酸跟足量的锌片反应,为增大反应速率,又不影响生产氢气的总量,可采取的方法是( )
| A. | 加入适量的5mol•L-1的硫酸 | B. | 加入少量醋酸钠固体 | ||
| C. | 加热 | D. | 加入少量金属钠 |
7.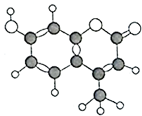 某种有机物由C、H、O三种元素组成,其分子球棍模型如图所示,下列有关叙述正确的是( )
某种有机物由C、H、O三种元素组成,其分子球棍模型如图所示,下列有关叙述正确的是( )
①分子式为C10H9O3
②该分子中10个碳原子都可能在同一平面上
③1mol该物质最多能与5molH2加成
④该物质能使酸性KMnO4溶液褪色
⑤1mol该物质最多能与含3molNaOH的溶液反应
⑥1mol该物质与足量浓溴水反应,最多消耗3molBr2
⑦该物质遇FeCl2溶液不变色
⑧该物质能和Na2CO3溶液、NaHCO3溶液反应.
 某种有机物由C、H、O三种元素组成,其分子球棍模型如图所示,下列有关叙述正确的是( )
某种有机物由C、H、O三种元素组成,其分子球棍模型如图所示,下列有关叙述正确的是( )①分子式为C10H9O3
②该分子中10个碳原子都可能在同一平面上
③1mol该物质最多能与5molH2加成
④该物质能使酸性KMnO4溶液褪色
⑤1mol该物质最多能与含3molNaOH的溶液反应
⑥1mol该物质与足量浓溴水反应,最多消耗3molBr2
⑦该物质遇FeCl2溶液不变色
⑧该物质能和Na2CO3溶液、NaHCO3溶液反应.
| A. | ①②④⑥ | B. | ②③⑤⑥ | C. | ②④⑦⑧ | D. | ②④⑤⑥ |
16.下列离子方程式正确的是( )
| A. | FeBr2溶液中通入少量的Cl2:Cl2+2Fe2+═2Fe3++2Cl- | |
| B. | 大理石溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 向NaHSO4溶液中滴加Ba(OH)2至刚好沉淀完全:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | NaOH溶液中通入过量SO2气体:SO2+2OH-═SO32-+H2O |
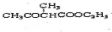 +HCl
+HCl
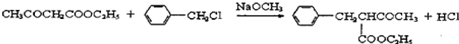 ,其反应类型为取代反应
,其反应类型为取代反应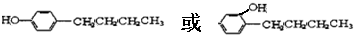 .
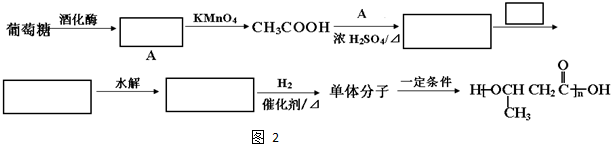
.
 除氢元素外,非金属元素都在p区,d区元素全部是金属.
除氢元素外,非金属元素都在p区,d区元素全部是金属.