题目内容
7.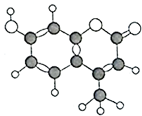 某种有机物由C、H、O三种元素组成,其分子球棍模型如图所示,下列有关叙述正确的是( )
某种有机物由C、H、O三种元素组成,其分子球棍模型如图所示,下列有关叙述正确的是( )①分子式为C10H9O3
②该分子中10个碳原子都可能在同一平面上
③1mol该物质最多能与5molH2加成
④该物质能使酸性KMnO4溶液褪色
⑤1mol该物质最多能与含3molNaOH的溶液反应
⑥1mol该物质与足量浓溴水反应,最多消耗3molBr2
⑦该物质遇FeCl2溶液不变色
⑧该物质能和Na2CO3溶液、NaHCO3溶液反应.
| A. | ①②④⑥ | B. | ②③⑤⑥ | C. | ②④⑦⑧ | D. | ②④⑤⑥ |
分析 根据有机物的价键规则(碳原子形成4条键,氧原子形成2条键,氢原子形成1条键)可写出该有机物的结构简式为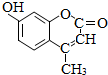 ,含酚-OH、C=C、-COOC-,结合苯酚、烯烃、酯的性质来解答.
,含酚-OH、C=C、-COOC-,结合苯酚、烯烃、酯的性质来解答.
解答 解:①由有机物的结构简式可知分子式为C10H8O3,故①错误;
②苯环和碳碳双键为平面形结构,则该分子中10个碳原子都可能在同一平面上,故②正确;
③能与氢气发生加成反应的为苯环和碳碳双键,1mol该物质最多能与4molH2加成,故③错误;
④含有碳碳双键,可被氧化,则该物质能使酸性KMnO4溶液褪色,故④正确;
⑤能与氢氧化钠反应的官能团为酚羟基和酯基,则1mol该物质最多能与含3molNaOH的溶液反应,故⑤正确;
⑥酚羟基邻位可被溴水取代,碳碳双键可与溴水发生加成反应,则1mol该物质与足量浓溴水反应,最多消耗3molBr2,故⑥正确;
⑦含有酚羟基,可与氯化铁发生显色反应,故⑦错误;
⑧含有酚羟基,酸性比碳酸弱,比碳酸氢钠强,可与碳酸钠反应,但与碳酸氢钠不反应,故⑧错误.
故选D.
点评 本题考查有机物的结构与性质,为高考常见题型,把握官能团及性质的关系为解答的关键,熟悉苯酚、烯烃的性质为即可解答,题目难度不大.

练习册系列答案
相关题目
17.几种短周期元素的原子半径及主要化合价如下表,下列说法正确的是( )
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要 化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | -- |
| 最低负价 | -- | -1 | -- | -- | -3 | -2 | |
| A. | X、Z、R的最高价氧化物的水化物之间可两两相互反应 | |
| B. | 元素X和Q形成的化合物中不可能含有共价键 | |
| C. | X、Z、M的单质分别与水反应,M最剧烈 | |
| D. | Y的氢化物的水溶液可用于雕刻玻璃 |
18.下列金属冶炼的方法错误的是( )
| A. | 加热分解Ag2O冶炼银 | B. | 用CO还原氧化铁冶炼铁 | ||
| C. | 钠与Mg2Cl溶液反应冶炼镁 | D. | 电解熔融氧化铝冶炼铝 |
2.下列说法正确的是( )
| A. | 元素周期表中,电子层数越多,半径一定越大 | |
| B. | 元素周期表中,同一主族,随着核电荷数的递增,熔沸点逐渐降低 | |
| C. | 非金属元素与非金属元素之间可能形成离子键 | |
| D. | 含有离子键的物质一定是离子化合物,只含共价键的物质一定是共价化合物 |
12.A、B、C、D、E是同周期元素,A、B的最高价氧化物的水化物呈碱性,且B比A的碱性强,C、D最高价氧化物水化物是酸,且C比D的酸性强,E是这五种元素中原子半径最大的,则它们的原子序数由小到大的顺序为( )
| A. | E、B、A、D、C | B. | D、B、C、A、E | C. | E、C、D、B、A | D. | A、B、C、D、E |
19.向25mL 2mol•L-1的稀硫酸中加入25mL 1mol•L-1的BaCl2溶液,充分反应后,溶液中H+物质的量浓度为(溶液混后体积变化忽略不计)( )
| A. | 2mol•L-1 | B. | 1mol•L-1 | C. | 0.5mol•L-1 | D. | 0.25mol•L-1 |
4.NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1.0 L 1.0 mol•L-1的NaClO水溶液中含有的氧原子数为NA | |
| B. | 总质量为a g的CO和N2的混合物中所含原子总数为$\frac{a{N}_{A}}{14}$ | |
| C. | 2.24 L的2H35Cl分子中的中子数是1.9NA | |
| D. | 某密闭容器中盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,形成N-H键的数目为0.6NA |
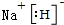 ,QX与X2Z反应生成X单质的化学方程式为NaH+H2O=NaOH+H2↑.
,QX与X2Z反应生成X单质的化学方程式为NaH+H2O=NaOH+H2↑.