题目内容
8.资料一:考古工作者从安阳的商代铸铜遗址中,发现当时冶炼铜的主要矿物原料是孔雀石(Cu2(OH)2CO3),主要燃料是木炭,冶炼温度估计在1000℃左右.资料二:西汉刘安著《淮南万毕术》中记载“曾青得铁则化为铜”.“曾青”可能是硫酸铜一类的物质,将孔雀石溶于硫酸中得此溶液,当把铁粉投入此溶液中即可得铜.
(1)关于“曾青”和孔雀石的水溶性分析中,判断正确的是A
A.前者可溶,后者难溶 B.前者难溶,后者可溶
C.两者均可溶 D.两者均难溶
(2)以孔雀石为原料的冶炼过程中,用现代化学的观念审视,可能涉及的化学反应有D
①Cu2(OH)2CO3$\frac{\underline{\;△\;}}{\;}$2CuO+CO2↑+H2O
②2CuO+C $\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑
③CuO+CO $\frac{\underline{\;高温\;}}{\;}$Cu+CO2
④CO2+C $\frac{\underline{\;高温\;}}{\;}$2CO
A.①②B.①③C.①②③D.①②③④
(3)在(2)的四个反应中,不属于四种基本反应类型的有(填序号,下同)③,不属于氧化还原反应的有①.
(4)资料二中,假设溶解孔雀石的酸是稀硫酸,写出用此方法冶炼铜的化学方程式Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O,CuSO4+Fe=FeSO4+Cu.
分析 (1)曾青为硫酸铜,可溶于水,孔雀石不溶于水;
(2)孔雀石为原料的冶炼时可能涉及的反应为;孔雀石高温分解生成氧化铜、水和二氧化碳;碳还原氧化铜生成铜和二氧化碳;碳和二氧化碳生成一氧化碳;一氧化碳具有还原性还原氧化铜;
(3)根据四种基本反应类型的特点以及氧化还原反应的特点来分析;
(4)Cu2(OH)2CO3与硫酸反应生成硫酸铜、水和二氧化碳,铁与硫酸铜反应生成硫酸亚铁和铜.
解答 解:(1)由资料一:孔雀石为矿物原料,可知孔雀石难溶于水,由资料二:“曾青得铁则化为铜”可知铁把铜从它的盐溶液中置换出来,所以“曾青”可溶于水,
故答案为:A;
(2)孔雀石为原料的冶炼时可能涉及的反应为;孔雀石高温分解生成氧化铜、水和二氧化碳;碳还原氧化铜生成铜和二氧化碳;碳和二氧化碳生成一氧化碳;一氧化碳具有还原性还原氧化铜,
故答案为:D;
(3)反应①为一种物质生成三种物质,属于分解反应;反应②④均为单质和化合物生成另一种单质和化合物,属于置换反应;反应③不符合四种基本反应类型,只有①中元素化合价没有变化,不是氧化还原反应,
故答案为:③;①;
(4)Cu2(OH)2CO3与硫酸反应生成硫酸铜、水和二氧化碳,方程式为Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O,铁与硫酸铜反应生成硫酸亚铁和铜,方程式为CuSO4+Fe=FeSO4+Cu,
故答案为:Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O;CuSO4+Fe=FeSO4+Cu.
点评 本题综合考查铜及其化合物等知识,侧重于学生的分析能力以及元素化合物知识的综合理解和运用的考查,有利于培养学生的良好的科学素养,难度不大.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
19.下列金属活动性最强的( )
| A. | Mg | B. | Ag | C. | Cu | D. | Zn |
13.N20俗称“笑气”,医疗上曾用作可吸入性麻醉剂,下列反应能产生N20:3C0+2N02=3C02+N2O.下列关于N20的说法一定正确的是( )
| A. | 上述反应中,每消耗2mol NO2,就会生成22.4L N20 | |
| B. | N20有氧化性,且为HN02的酸酐 | |
| C. | 等质量的N20和C02含有相等的电子数 | |
| D. | N20会迅速与人体血红蛋白结合,使人中毒 |
20.在强碱溶液中,可能大量存在的离子组是( )
| A. | Na+、K+、AlO2-、Cl- | B. | Ba2+、Na+、Al3+、SO42- | ||
| C. | K+、Mg2+、Cl-、NO3- | D. | Na+、Ca2+、Cl-、HCO3- |
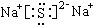 ,
,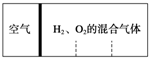 如图所示,分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的$\frac{1}{4}$)、H2和O2的混合气体,在标准状况下,若将H2、O2的混合气体点燃引爆.活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央.则原来H2、O2的体积之比可能为7:2 或4:5.
如图所示,分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的$\frac{1}{4}$)、H2和O2的混合气体,在标准状况下,若将H2、O2的混合气体点燃引爆.活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央.则原来H2、O2的体积之比可能为7:2 或4:5.