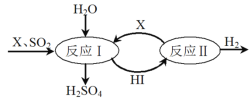
题目内容
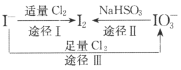
【题目】I-具有还原性,含碘食盐中的碘元素主要以KIO3的形式存在,I-、I2、IO3-在一定条件下可发生如图转化关系。下列说法不正确的是
A.用淀粉-KI试纸和食醋可检验食盐是否加碘
B.由图可知氧化性的强弱顺序为C12>IO3->I2
C.生产等量的碘,途径I和途径Ⅱ转移电子数目之比为2:5
D.途径Ⅲ反应的离子方程式:3C12+I-+3H2O=6C1-+IO3-+6H+
【答案】C
【解析】
A. 碘食盐中的碘元素主要以KIO3的形式存在,IO3-和I-在酸性条件下可生成I2,I2遇淀粉变蓝,A正确;
B. 由图途径Ⅲ可知,Cl2可将I-氧化为IO3-,氧化性Cl2>IO3-,途径Ⅱ可知IO3-可被还原为I2,氧化性为IO3->I2,则氧化性的强弱顺序为Cl2>IO3->I2,B正确;
C. 生产1mol碘,途径I中-1价碘转变为0价碘,需要转移2mol电子,途径Ⅱ中+5价碘转变为0价碘,需要转移10mol电子,故转移电子数目之比为1:5,C错误;
D. 途径Ⅲ中Cl2可将I-氧化为IO3-,而氯气被还原为Cl-,根据得失电子守恒和质量守恒,反应的离子方程式为:3Cl2+I-+3H2O=6Cl-+IO3-+6H+,D正确;
答案选C。

 阅读快车系列答案
阅读快车系列答案【题目】某研究小组将纯净的SO2气体缓缓的通入到盛有25mL0.1mol· L-1的Ba(NO3)2溶液中,得到BaSO4沉淀。为探究该反应中的氧化剂,该小组提出了如下假设:
假设Ⅰ:溶液中的NO3-;
假设Ⅱ:________________。
(1)该小组设计了以下实验验证了假设Ⅰ成立(为排除假设Ⅱ对假设Ⅰ的干扰,在配制下列实验所用溶液时,应___________________),请填写下表。
实验步骤 | 实验现象 | 结论 | |
实验① | 向盛有25mL0.1mol·L-1BaCl2溶液的烧杯中缓慢通入纯净的SO2气体 | ______ | 假设Ⅰ成立 |
实验② | 向盛有25mL0.1mol· L-1Ba(NO3)2溶液的烧杯中缓慢通入纯净的SO2气体 | ______ | |
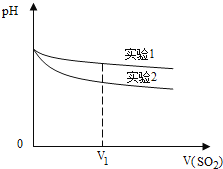
(2)为深入研究该反应,该小组还测得上述两个实验中溶液的pH随通入SO2体积的变化曲线如图。V1时,实验②中溶液pH小于实验①的原因是(用离子方程式表示):________。
(3)验证假设Ⅱ。某同学设计了以下方案,请完成下列表格(可以不填满)。
实验步骤 | 实验现象 | 实验目的 | ||
实验③ | 同实验①步骤 | 同实验①的相关现象 | ______ | |
实验④ | ______ | ______ | ______ | |
(4)查资料知:H2SO3是二元酸(Kl=1.54×10-2,K2=1.02×10-7),请设计实验方案验证H2SO3是二元酸______(试剂及仪器自选)。