题目内容
【题目】KClO3和浓盐酸在一定温度下反应,会生成橙黄色的易爆物二氧化氯(ClO2)气体,该反应的化学方程式为2KClO3+4HCl(浓) === 2KCl + 2ClO2↑+ Cl2↑+ 2H2O。
(1)该反应中还原产物与氧化产物的物质的量之比为_________________。
(2)若该反应中有490克KClO3参加反应,则被氧化的HCl的质量为______________。
(3)若该反应产生2.24L(标准状况)ClO2,则转移的电子数目为_____________。
(4)某地生产的食盐氯化钠中含有少量的剧毒物质氰化钠(NaCN),用ClO2可除去其中的氰化钠,从而得到纯净的食盐,同时产生两种无毒气体。写出该反应的化学方程式: ______________________。
(5)用双线桥法表示下列氧化还原反应的电子转移情况:____________________
2KClO3+4HCl(浓) === 2KCl + 2ClO2↑+ Cl2↑+ 2H2O
【答案】2 : 1 146克 0.1NA 或6.02×1022 2NaCN + 2ClO2 = 2NaCl + 2CO2 + N2 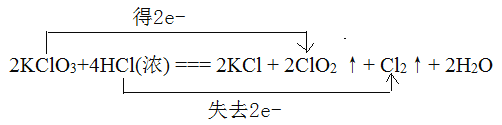
【解析】
氯酸钾中的氯元素化合价降低,做氧化剂,浓盐酸中的氯化合价升高,做还原剂。
(1)氯酸钾做氧化剂,生成二氧化氯是还原产物,盐酸做还原剂,生成的氯气为氧化产物,物质的量比为 2 : 1。
(2)方程式中当有2mol氯酸钾被还原,则被氧化的氯化氢为2mol,当有490克氯酸钾即490/122.5=4mol时被氧化的氯化氢为4mol,质量为146克。
(3)当生成2mol二氧化氯时转移电子为2mol,则当有2.24L即0.1mol二氧化氯生成时,转移电子为0.1mol,即0.1NA 或6.02×1022。
(4)氰化钠和二氧化氯反应生成两种无毒的气体,根据元素化合价分析,氯元素化合价降低,生成氯离子,碳元素化合价升高,生成二氧化碳,氮元素化合价升高生成氮气,方程式为: 2NaCN + 2ClO2 = 2NaCl + 2CO2 + N2。
(5)氯酸钾中氯元素化合价降低,得到电子,盐酸中的氯元素化合价升高,失去电子,双线桥为:

【题目】下表所示实验,现象和结论均正确的是
选项 | 实验 | 现象 | 结论 |
A | 向浓度均为0.lmol/LNaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
B | 常温下,测定等物质的量浓度的 Na2CO3和Na2SO3溶液的pH值 | 前者的pH值比后者的大 | 非金属性:S>C |
C | 向某溶液中加入硝酸酸化的氯化钡溶液 | 溶液中有白色沉淀生成 | 该溶液中含有SO42- |
D | 向FeCl3和KSCN混合溶液中,加入少量KC1固体 | 溶液颜色变浅 | FeCl3+3KSCN |
A. A B. B C. C D. D