题目内容
【题目】汽车尾气中含有CO和NOx,减轻其对大气的污染成为科研工作的热点问题。回答下列问题:
(1)已知下列热化学方程式:CO(g)+2H2(g)![]() CH3OH(g) ΔH1,CO2(g)+3H2(g)=CH3OH(g) +H2O(g) ΔH2=-49.0kJ·mol-1,CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.1kJ·mol-1。
CH3OH(g) ΔH1,CO2(g)+3H2(g)=CH3OH(g) +H2O(g) ΔH2=-49.0kJ·mol-1,CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.1kJ·mol-1。
则ΔH1=_________kJ·mol-1。
(2)用活化后的V2O5作催化剂,氨气可将NO还原成N2。
①V2O5能改变反应速率是通过改变________实现的。
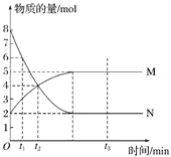
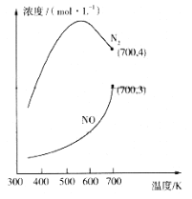
②在1L的刚性密闭容器中分别充入6 mol NO、6 mol NH3和适量O2,控制不同温度,均反应tmin,测得容器中部分含氮气体浓度随温度的变化如图所示。NO浓度始终增大的原因可能是______。700K时,0~tmin内,体系中氨气的平均反应速率为______(用含t的式子表示)。
(3)科学家研究出了一种高效催化剂,可以将CO和NO2两者转化为无污染气体,反应的热化学方程式为:2NO2(g)+4CO(g)![]() 4CO2(g) +N2(g) ΔH<0。某温度下,向10L恒容密闭容器中充入0.1 mol NO2和0.2 mol CO,发生上述反应,随着反应的进行,容器内的压强变化如下表所示:
4CO2(g) +N2(g) ΔH<0。某温度下,向10L恒容密闭容器中充入0.1 mol NO2和0.2 mol CO,发生上述反应,随着反应的进行,容器内的压强变化如下表所示:
时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
压强/kPa | 75 | 73.4 | 71.96 | 70.7 | 69.7 | 68.75 | 68.75 |
在此温度下,反应的平衡常数Kp =________kPa-1(Kp为以分压表示的平衡常数);若保持温度不变,再将CO、CO2气体浓度分别增加一倍,则平衡________(填“右移” “左移”或“不移动”)。
【答案】-90.1 反应的活化能 NH3和O2反应生成NO ![]() 0.04 不移动
0.04 不移动
【解析】
(3)首先根据三段式法计算平衡体系中各物质的物质的量或物质的量浓度,其次计算各气体组分的物质的量分数或体积分数,根据分压计算分式求出各气体物质的分压,再根据平衡常数计算公式代入计算。
(1)利用盖斯定律,结合题意可知ΔH1=ΔH2+ΔH3=-49.0 kJ·mol-1+(-41.1kJ·mol-1)=-90.1kJ·mol-1,答案为:-90.1;
(2)①催化剂通过参与反应改变反应历程,降低反应的活化能来提高反应速率,故答案为:反应的活化能;
②根据题意,NH3和O2可能发生反应:4NH3+5O2![]() 4NO+6H2O,有NO生成,故NO的浓度始终增大。根据原子守恒可知,反应起始时,6molNO和6molNH3共有
4NO+6H2O,有NO生成,故NO的浓度始终增大。根据原子守恒可知,反应起始时,6molNO和6molNH3共有![]() ;700K时,n(NO)=3mol,n(N2)=4mol,则700K时,n(NH3)=
;700K时,n(NO)=3mol,n(N2)=4mol,则700K时,n(NH3)=![]() ,由此可知,Δn(NH3)=6mol-1mol=5mol,0~tmin内,体系中氨气的平均反应速率为
,由此可知,Δn(NH3)=6mol-1mol=5mol,0~tmin内,体系中氨气的平均反应速率为 。答案为:NH3和O2反应生成NO;
。答案为:NH3和O2反应生成NO;![]() ;
;
(3)由表中数据可知,向10L恒容密闭容器中充入0.1 mol NO2和0.2 mol CO,10min时反应处于平衡状态,体系内压强由75kPa减少到68.75kPa,设平衡时转化的NO2的物质的量浓度为2x,由题意可知,起始时,c(CO)=![]() ,c(NO2)=0.01molL-1。列三段式进行计算得:
,c(NO2)=0.01molL-1。列三段式进行计算得:

则![]() ,即
,即![]() ,解得:x=0.0025molL-1。则平衡时的n(NO2)=0.05mol,n(CO)=n(CO2)=0.1mol,n(N2)=0.025mol。根据p(A)=
,解得:x=0.0025molL-1。则平衡时的n(NO2)=0.05mol,n(CO)=n(CO2)=0.1mol,n(N2)=0.025mol。根据p(A)=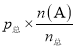 ,
,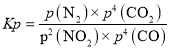 ,解得:Kp=0.04kPa-1。该温度下,K=
,解得:Kp=0.04kPa-1。该温度下,K=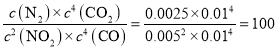 ,若平衡后,再将CO、CO2气体的浓度分别增加一倍,因为c(CO)=c(CO2),则Qc=K,平衡不移动。答案为:0.04;不移动。
,若平衡后,再将CO、CO2气体的浓度分别增加一倍,因为c(CO)=c(CO2),则Qc=K,平衡不移动。答案为:0.04;不移动。

 阅读快车系列答案
阅读快车系列答案