题目内容
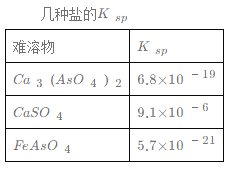
【题目】钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图所示。下列说法不正确的是
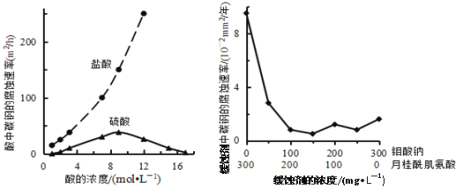
A. 盐酸的浓度越大,腐蚀速率越快
B. 钼酸钠和月桂酰肌氨酸的浓度相等时,腐蚀速率最小
C. 碳素钢的腐蚀速率不随硫酸的浓度增大而增大,说明反应速率不与c(H+)成正比
D. 对比盐酸和硫酸两条曲线,可知Cl—也会影响碳素钢的腐蚀速率
【答案】C
【解析】
A.由酸的浓度对腐蚀速率的影响图可知,盐酸的浓度越大,腐蚀速率越快,故A正确;B.由图可知,曲线的最低点腐蚀速率最小,则钼酸钠和月桂酰肌氨酸的浓度相等时,腐蚀速率最小,故B正确;C.浓硫酸有强氧化性,能使金属表面形成致密的氧化膜保护层,则硫酸浓度较大时不能说明速率与氢离子的关系,故C错误;D.碳素钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,可知Cl-有利于碳素钢的腐蚀,SO42-不利于碳素钢的腐蚀,故D正确;故选C。

练习册系列答案
相关题目