题目内容
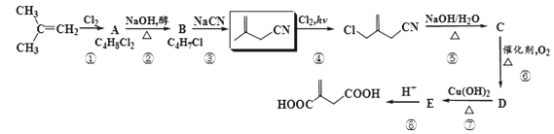
【题目】现有以异丁烯为原料合成某二酸的合成路线如图:
已知:R-CH2CN![]() R-CH2COONa+NH3
R-CH2COONa+NH3
(1)A的系统命名是__,B的官能团名称__。
(2)步骤③的反应类型是__。
(3)同一有机物中的两个同种官能团在反应时,一者参与反应占绝大多数,另一者几乎不反应,这被称之为“位置专一性”。请从反应物结构角度,简要解释步骤②中消去氯原子时的位置专一性:__。
(4)步骤⑤的产物C经酸化后,可发生分子内酯化,写出该内酯的结构简式___。
(5)写出步骤⑥的化学方程式__。
(6)均符合下列条件B的同分异构体为__。
a.所有碳原子一定共平面;b.核磁共振氢谱有3组峰。
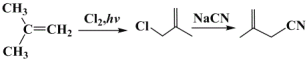
(7)利用题目给的信息,写出由异丁烯为原料,两步合成![]() 的路线流程___。
的路线流程___。
【答案】2—甲基—1,2—二氯丙烷或1,2—二氯—2—甲基丙烷 碳碳双键、氯原子 取代反应 因为A物质中有一个Cl-官能团邻位无H原子,故它不易消去HCl而反应 ![]() 2
2![]() +O2
+O2![]() 2H2O+2
2H2O+2 ![]() 。
。 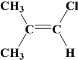 、
、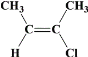 、
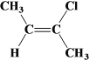
、
【解析】
![]() 与Cl2反应生成A,由A的分子式可确定其结构简式为
与Cl2反应生成A,由A的分子式可确定其结构简式为 ,它在NaOH醇溶液中发生消去反应生成B的结构简式为
,它在NaOH醇溶液中发生消去反应生成B的结构简式为![]() ,与NaCN发生取代反应生成
,与NaCN发生取代反应生成![]() ,
,![]() 与Cl2、hv作用下生成
与Cl2、hv作用下生成![]() ,依据信息可知,
,依据信息可知,![]() 在NaOH水溶液中加热,生成C的结构简式为
在NaOH水溶液中加热,生成C的结构简式为![]() ,C催化氧化生成D的结构简式为
,C催化氧化生成D的结构简式为![]() ,D再被Cu(OH)2氧化生成E的结构简式为
,D再被Cu(OH)2氧化生成E的结构简式为![]() ,E 与酸反应生成
,E 与酸反应生成![]() 。
。
(1)A的结构简式为 ,系统命名是2—甲基—1,2—二氯丙烷或1,2—二氯—2—甲基丙烷,B的结构简式为
,系统命名是2—甲基—1,2—二氯丙烷或1,2—二氯—2—甲基丙烷,B的结构简式为![]() ,官能团名称为碳碳双键、氯原子。答案为:2—甲基—1,2—二氯丙烷或1,2—二氯—2—甲基丙烷;碳碳双键、氯原子;
,官能团名称为碳碳双键、氯原子。答案为:2—甲基—1,2—二氯丙烷或1,2—二氯—2—甲基丙烷;碳碳双键、氯原子;
(2)步骤③为![]() 与NaCN反应生成
与NaCN反应生成![]() 和NaCl,反应类型是取代反应。答案为:取代反应;
和NaCl,反应类型是取代反应。答案为:取代反应;
(3)步骤②中, 在NaOH醇溶液中发生消去反应生成
在NaOH醇溶液中发生消去反应生成![]() ,消去氯原子时,邻位上必须存在氢原子,由此得出位置专一性的原因:因为A物质中有一个Cl-官能团邻位无H原子,故它不易消去HCl而反应。答案为:因为A物质中有一个Cl-官能团邻位无H原子,故它不易消去HCl而反应;
,消去氯原子时,邻位上必须存在氢原子,由此得出位置专一性的原因:因为A物质中有一个Cl-官能团邻位无H原子,故它不易消去HCl而反应。答案为:因为A物质中有一个Cl-官能团邻位无H原子,故它不易消去HCl而反应;
(4)步骤⑤的产物C为![]() ,经酸化后生成
,经酸化后生成![]() ,可发生分子内酯化,该内酯的结构简式为
,可发生分子内酯化,该内酯的结构简式为![]() 。答案为:
。答案为:![]() ;
;
(5)步骤⑥中,![]() 催化氧化生成
催化氧化生成![]() ,化学方程式为2
,化学方程式为2![]() +O2
+O2![]() 2H2O+2
2H2O+2 ![]() 。答案为:2
。答案为:2![]() +O2
+O2![]() 2H2O+2
2H2O+2 ![]() ;
;
(6)B的结构简式为![]() ,满足条件:a.所有碳原子一定共平面;b.核磁共振氢谱有3组峰,分子中的碳原子要么为双键碳原子,要么连在双键碳原子上,同分异构体为:
,满足条件:a.所有碳原子一定共平面;b.核磁共振氢谱有3组峰,分子中的碳原子要么为双键碳原子,要么连在双键碳原子上,同分异构体为: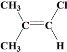 、
、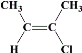 、
、 。答案为:
。答案为: 、
、 、
、 ;
;
(7)由![]() 制取
制取![]() ,只允许两步合成,则应为先用Cl2取代,后用NaCN取代,路线流程为
,只允许两步合成,则应为先用Cl2取代,后用NaCN取代,路线流程为 。答案为:
。答案为: 。
。

 阅读快车系列答案
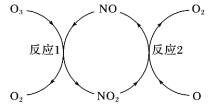
阅读快车系列答案【题目】汽车尾气中含有CO和NOx,减轻其对大气的污染成为科研工作的热点问题。回答下列问题:
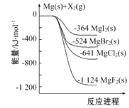
(1)已知下列热化学方程式:CO(g)+2H2(g)![]() CH3OH(g) ΔH1,CO2(g)+3H2(g)=CH3OH(g) +H2O(g) ΔH2=-49.0kJ·mol-1,CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.1kJ·mol-1。
CH3OH(g) ΔH1,CO2(g)+3H2(g)=CH3OH(g) +H2O(g) ΔH2=-49.0kJ·mol-1,CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.1kJ·mol-1。
则ΔH1=_________kJ·mol-1。
(2)用活化后的V2O5作催化剂,氨气可将NO还原成N2。
①V2O5能改变反应速率是通过改变________实现的。
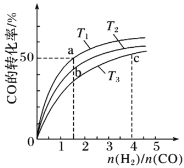
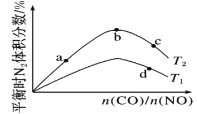
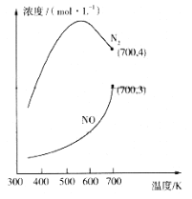
②在1L的刚性密闭容器中分别充入6 mol NO、6 mol NH3和适量O2,控制不同温度,均反应tmin,测得容器中部分含氮气体浓度随温度的变化如图所示。NO浓度始终增大的原因可能是______。700K时,0~tmin内,体系中氨气的平均反应速率为______(用含t的式子表示)。
(3)科学家研究出了一种高效催化剂,可以将CO和NO2两者转化为无污染气体,反应的热化学方程式为:2NO2(g)+4CO(g)![]() 4CO2(g) +N2(g) ΔH<0。某温度下,向10L恒容密闭容器中充入0.1 mol NO2和0.2 mol CO,发生上述反应,随着反应的进行,容器内的压强变化如下表所示:
4CO2(g) +N2(g) ΔH<0。某温度下,向10L恒容密闭容器中充入0.1 mol NO2和0.2 mol CO,发生上述反应,随着反应的进行,容器内的压强变化如下表所示:
时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
压强/kPa | 75 | 73.4 | 71.96 | 70.7 | 69.7 | 68.75 | 68.75 |
在此温度下,反应的平衡常数Kp =________kPa-1(Kp为以分压表示的平衡常数);若保持温度不变,再将CO、CO2气体浓度分别增加一倍,则平衡________(填“右移” “左移”或“不移动”)。