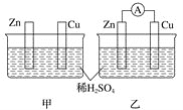
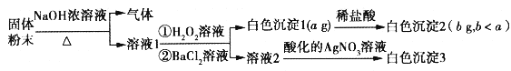
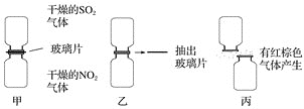
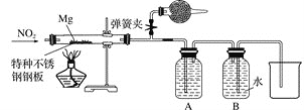
题目内容
【题目】氰化物是剧毒物质,传统生产工艺的电镀废水中含一定浓度的CN-,无害化排放时必须对这种废水进行处理。 可采用碱性条件下的Cl2氧化法处理这种废水,涉及两个反应:反应i,CN- +OH-+Cl2![]() OCN- +Cl-+H2O(未配平);
OCN- +Cl-+H2O(未配平);
反应ii,OCN- + OH-+ Cl2![]() X + Y + Cl-+ H2O(未配平)。
X + Y + Cl-+ H2O(未配平)。
其中反应i中N元素的化合价没有变化,常温下,X、Y是两种无毒的气体。下列判断正确的是( )
A.反应i中氧化剂与还原剂的化学计量数之比为1: 1
B.X、Y是CO2、N2,且均为反应ii的氧化产物
C.该废水处理工艺过程中须采取措施,防止Cl2逸出到空气中
D.处理c(CN-) =0.000 1 mol·L-1的废水106 L,消耗标况下的Cl2 4.48×103L
【答案】AC
【解析】
A. 反应i中氧化剂是Cl2,还原剂是CN-,Cl2中的氯元素的化合价降低2,CN-中的碳元素的合价升高2(由+2升高到+4),因此i中氧化剂与还原剂的化学计量数之比为1: 1,故A正确;
B. 由题中信息可知,X、Y是两种无毒的气体,由反应所涉及的元素可知,X、Y是CO2、N2,N2为反应ii的氧化产物,CO2不是反应ii的氧化产物,故B错误;
C. 氯气有毒,因此该废水处理工艺过程中须采取措施防止Cl2逸出到空气中,故C正确;
D. 处理c(CN-) =0.000 1 mol·L-1的废水106 L,物质的量为0.000 1 mol·L1×106 L=100mol,则失去电子100mol×(2+3)=500mol,因此消耗氯气250mol,标况下的Cl2 体积为250mol×22.4 L·mol1=5.6×103L,故D错误。
综上所述,答案为AC。

【题目】汽车尾气中含有CO和NOx,减轻其对大气的污染成为科研工作的热点问题。回答下列问题:
(1)已知下列热化学方程式:CO(g)+2H2(g)![]() CH3OH(g) ΔH1,CO2(g)+3H2(g)=CH3OH(g) +H2O(g) ΔH2=-49.0kJ·mol-1,CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.1kJ·mol-1。
CH3OH(g) ΔH1,CO2(g)+3H2(g)=CH3OH(g) +H2O(g) ΔH2=-49.0kJ·mol-1,CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.1kJ·mol-1。
则ΔH1=_________kJ·mol-1。
(2)用活化后的V2O5作催化剂,氨气可将NO还原成N2。
①V2O5能改变反应速率是通过改变________实现的。
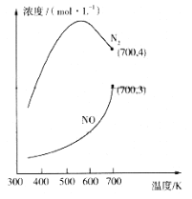
②在1L的刚性密闭容器中分别充入6 mol NO、6 mol NH3和适量O2,控制不同温度,均反应tmin,测得容器中部分含氮气体浓度随温度的变化如图所示。NO浓度始终增大的原因可能是______。700K时,0~tmin内,体系中氨气的平均反应速率为______(用含t的式子表示)。
(3)科学家研究出了一种高效催化剂,可以将CO和NO2两者转化为无污染气体,反应的热化学方程式为:2NO2(g)+4CO(g)![]() 4CO2(g) +N2(g) ΔH<0。某温度下,向10L恒容密闭容器中充入0.1 mol NO2和0.2 mol CO,发生上述反应,随着反应的进行,容器内的压强变化如下表所示:
4CO2(g) +N2(g) ΔH<0。某温度下,向10L恒容密闭容器中充入0.1 mol NO2和0.2 mol CO,发生上述反应,随着反应的进行,容器内的压强变化如下表所示:
时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
压强/kPa | 75 | 73.4 | 71.96 | 70.7 | 69.7 | 68.75 | 68.75 |
在此温度下,反应的平衡常数Kp =________kPa-1(Kp为以分压表示的平衡常数);若保持温度不变,再将CO、CO2气体浓度分别增加一倍,则平衡________(填“右移” “左移”或“不移动”)。