题目内容
19. 原子序数小于36的X、Y、Z、W四种元素,X基态原子的最外层电子数是其内层电子数的2倍,Y基态原子的2p原子轨道上有3个未成对电子,Z是地壳中含量最多的元素,W的原子序数为22.
原子序数小于36的X、Y、Z、W四种元素,X基态原子的最外层电子数是其内层电子数的2倍,Y基态原子的2p原子轨道上有3个未成对电子,Z是地壳中含量最多的元素,W的原子序数为22.(1)W基态原子的核外电子排布式为1s22s22p63s23p63d24s2.元素X、Y、Z的电负性由大到小的顺序为O>N>C.
(2)与XYZ-互为等电子体的一种分子、一种离子分别为CO2、SCN-(填化学式).
(3)二元弱酸H2X2Z4中X原子轨道的杂化类型是sp2,1mol H2X2Z4分子中含有σ键的数目为7NA.
(4)YH3极易溶于水的主要原因是氨分子与水分子间易形成氢键.元素W的氧化物WO2可与氢氟酸发生非氧化还原反应,生成配合物HnWF6,该反应的化学方程式为TiO2+6HF=H2TiF6+2H2O.
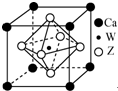
(5)Z、W与Ca形成晶体的晶胞如图所示,该晶体的化学式为CaTiO3.
分析 元素X的原子最外层电子数是其内层的2倍,原子只能有2个电子层,最外层电子数为4,故X为C元素;Y基态原子的2p轨道上有3个电子,Y的核外电子排布式为1s22s22p3,则Y为N元素;Z是地壳中含量最多的元素,则Z为O元素;W的原子序数为22,则W为Ti,据此解答.
解答 解:元素X的原子最外层电子数是其内层的2倍,原子只能有2个电子层,最外层电子数为4,故X为C元素;Y基态原子的2p轨道上有3个电子,Y的核外电子排布式为1s22s22p3,则Y为N元素;Z是地壳中含量最多的元素,则Z为O元素;W的原子序数为22,则W为Ti.
(1)W核外电子数为22,基态原子的核外电子排布式为1s22s22p63s23p63d24s2;
同周期随原子序数增大,元素电负性增大,故电负性O>N>C,
故答案为:1s22s22p63s23p63d24s2;O>N>C;
(2)原子总数相等、价电子总数相等微粒互为得电子,与CNO-互为等电子体的一种分子、一种离子分别为CO2、SCN-等,
故答案为:CO2、SCN-;
(3)二元弱酸H2C2O4的结构式为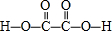 ,分子中C原子形成3个σ键,没有孤电子对,故C原子轨道的杂化类型是sp2,1mol H2C2O4分子中含有σ键的数目为7NA,
,分子中C原子形成3个σ键,没有孤电子对,故C原子轨道的杂化类型是sp2,1mol H2C2O4分子中含有σ键的数目为7NA,
故答案为:sp2;7NA;
(4)氨分子与水分子间易形成氢键,NH3极易溶于水;
元素W的氧化物TiO2可与氢氟酸发生非氧化还原反应,生成配合物HnTiF6,由化合价代数和为0,可知n=2,故该反应的化学方程式为:TiO2+6HF=H2TiF6+2H2O,
故答案为:氨分子与水分子间易形成氢键;TiO2+6HF=H2TiF6+2H2O;
(5)晶胞中Ca原子数目为8×$\frac{1}{8}$=1,O原子数目为6×$\frac{1}{2}$=3,Ti原子数目为1,故化学式为:CaTiO3,
故答案为:CaTiO3.
点评 本题是对物质结构的考查,涉及核外电子排布、电负性、等电子体、杂化轨道、化学键、氢键、晶胞计算等,比较全面的考查物质结构主干知识,需要学生具备扎实的基础,难度中等.

| A. | 向溴水中滴入植物油,振荡后油层仍显无色,因此溴不溶于油脂 | |
| B. | FeCl3溶液可以腐蚀线路板上的Cu,因此Fe的金属活动性大于Cu | |
| C. | 常温下,2NO(g)+O2(g)=2NO2(g),因此该反应△H<0 | |
| D. | 相同浓度的Na2CO3溶液的碱性强于C6H5ONa,因此C6H5OH的酸性强于H2CO3 |
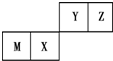
| A. | 原子半径Z<M | |
| B. | Y的最高价氧化物对应水化物的酸性比X的弱 | |
| C. | X的最简单气态氢化物的热稳定性比Z的小 | |
| D. | Z位于元素周期表中第2周期第ⅥA族 |
| A. | 向废液中加入少量的葡萄糖溶液,无红色沉淀产生,说明废液中不含Cu2+ | |
| B. | 向废液中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明废液中含有Cl- | |
| C. | 向废液中加少量铁粉,充分反应后无固体剩余,说明废液中含有Fe3+ | |
| D. | 向废液中滴加KSCN溶液,无现象,再加入氯水后溶呈血红色,说明废液中含有Fe2+ |
| A. | 在0.1 mol•L-1NaOH溶液中:K+、Na+、SO42-、HCO3- | |
| B. | 在0.1 mol•L-1Na2CO3溶液中:A13+、Na+、NO3-、C1- | |
| C. | 在0.1 mol•L-1FeCl3溶液中:K+、NH4+、I-、SCN- | |
| D. | 在$\frac{{c(H}^{+})}{{c(OH}^{-})}$=10-12的溶液中:K+、Na+、ClO-、NO3- |
| A. | 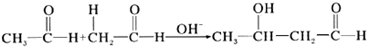 | |
| B. | CH2=CH-CH=CH2+2H2$→_{△}^{催化剂}$CH3-CH2-CH-CH3 | |
| C. | 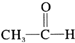 +H2$→_{△}^{催化剂}$CH3-CH-OH +H2$→_{△}^{催化剂}$CH3-CH-OH | |
| D. | CH3-CH2Br+NaOH$→_{△}^{H_{2}O}$CH3-CH2OH+NaBr |
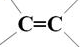 、-COOH.
、-COOH.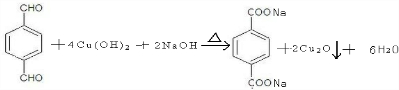 ;
;  .
.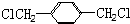 的同分异构体中含有苯环,且苯环上有三个取代基的同分异构体有16种.
的同分异构体中含有苯环,且苯环上有三个取代基的同分异构体有16种.