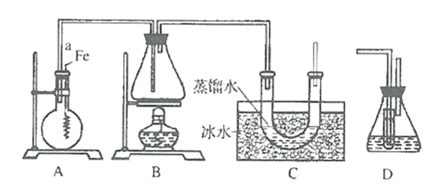
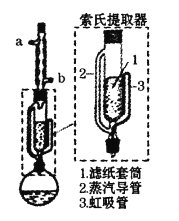
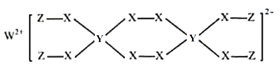
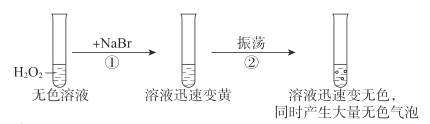
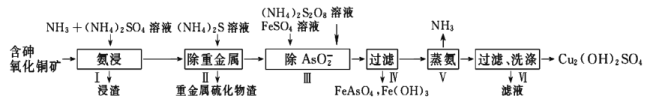
题目内容
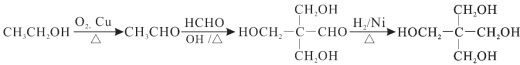
【题目】3,4-二羟基肉桂酸乙酯(I)具有抗炎作用和治疗自身免疫性疾病的潜力。由化合物A制备该物质的合成路线如下:
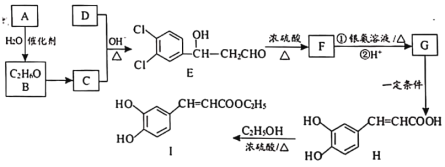
已知:R—CHO+R′—CH2—CHO![]()
![]()
回答下列问题:
(1)A的结构简式为___________。
(2)E生成F的反应类型为___________。
(3)下列有关H的说法中,不正确的是___________。
a.能使酸性高锰酸钾溶液褪色
b.1 mol H最多能和3 mol Br2反应
c.H分子中最多有9个碳原子共平面
d.l mol H分别与足量NaOH、NaHCO3反应时,消耗的NaOH、NaHCO3的物质的量之比为1:1
(4)写出C+D→E的化学方程式__________。
(5)已知W是H的同分异构体,符合下列条件的W结构共有________种。
①属于芳香族化合物。
②1 mol W与足量NaHCO3溶液反应生成气体44.8 L(标准状况)。其中,核磁共振氢谱有4组吸收峰,且峰面积比为1:2:2:3的结构简式为:_________。
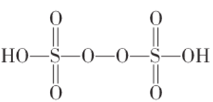
(6)季戊四醇(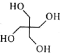 )是合成高效润滑剂、增塑剂、表面活性剂等的原料。设计由甲醛和乙醇为原料制备季戊四醇的合成路线(无机试剂任选)___________。(合成路线的表示方法为:A
)是合成高效润滑剂、增塑剂、表面活性剂等的原料。设计由甲醛和乙醇为原料制备季戊四醇的合成路线(无机试剂任选)___________。(合成路线的表示方法为:A![]() B……
B……![]() 目标产物)
目标产物)
【答案】CH2=CH2 消去反应 bd CH3CHO+![]()
![]()
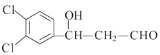 10
10 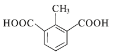 、
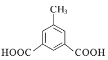
、
【解析】
由题中合成路线可知,A与水在催化剂的作用下生成C2H6O,则A为乙烯,B为乙醇;结合题中信息R—CHO+R′—CH2—CHO![]()
![]() 及E的结构可知,C为乙醛,D为
及E的结构可知,C为乙醛,D为![]() ;E发生消去反应生成F;F发生银镜反应后的产物经酸化转化为G;G在一定条件下发生取代反应生成H;H与乙醇发生酯化反应生成3,4-二羟基肉桂酸乙酯。
;E发生消去反应生成F;F发生银镜反应后的产物经酸化转化为G;G在一定条件下发生取代反应生成H;H与乙醇发生酯化反应生成3,4-二羟基肉桂酸乙酯。
(1)A为乙烯,其结构简式为CH2=CH2。
(2)醇在浓硫酸的作用下可以发生消去反应。结合E到H的各步反应的条件及H的结构,可以判断E生成F的反应类型为消去反应。
(3)a.H分子中有碳碳双键和酚羟基,故其能使酸性高锰酸钾溶液褪色,a说法正确;
b.H分子中苯环上的3个H原子可以被溴取代,碳碳双键可与溴发生加成反应,故1molH最多能和4molBr2反应,b说法不正确;
c.由苯分子的12原子共面及乙烯分子中6原子共面以及碳碳单键是可以旋转的可知,H分子中H最多有9个碳原子共平面,c说法正确;
d.H分子中的酚羟基和羧基都能与NaOH发生反应,但只有羧基可与NaHCO3反应,因此,lmolH分别与足量NaOH、NaHCO3反应时,消耗的NaOH、NaHCO3的物质的量之比为3:1,d说法不正确。
综上所述,说法不正确的有bd,故选bd。
(4)由题中信息R—CHO+R′—CH2—CHO![]()
![]() 可知,C+D→E的化学方程式为CH3CHO+
可知,C+D→E的化学方程式为CH3CHO+![]()
![]()
 。
。
(5)W是H(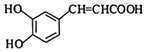 )的同分异构体,W结构的符合下列条件:
)的同分异构体,W结构的符合下列条件:
①属于芳香族化合物,则W分子中有苯环。
②1molW与足量NaHCO3溶液反应生成气体44.8L(标准状况),则W分子中有2个羧基。根据H的不饱和度及其所含有的碳原子数可知,若W的苯环上有3个取代基,即一个甲基和两个羧基,其在苯环上的排列方式有6种,若W的苯环上只有两个取代基,即-CH2COOH和-COOH,其在苯环的排列方式有3种;若W的苯环上只有一个取代基,则该取代基只能是-CH(COOH)2。综上所述,符合条件的W共有10种。其中,核磁共振氢谱有4组吸收峰,且峰面积比为1:2:2:3的结构简式为 和
和 。
。
(6)由甲醛和乙醇为原料制备季戊四醇,根据题中信息,首先把乙醇催化氧化为乙醛,然后乙醛和甲醛发生信息中的反应生成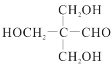 ,最后
,最后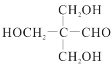 与氢气加成即可得到目标产品。具体合成路线如下:
与氢气加成即可得到目标产品。具体合成路线如下: 。
。

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案【题目】某同学研究金属锌与氯化铜溶液之间反应,在实验中该同学观察到的现象有:
i.产生少量气泡;ii.有红色固体生成;iii.溶液中产生白色沉淀。
为了解释上述现象,某同学查阅资料,获得如下信息:
编号 | 化学反应离子方程式 |
1 | Zn+Cu2+ |
2 | Zn+2Cu2+ |
3 | Cu++2Cl- |
4 | Cu++Cl- |
(1)请结合离子方程式解释产生少量气泡的原因:___。
(2)Zn与CuCl2反应生成白色沉淀的离子方程式是___。
(3)为了探究影响生成白色沉淀的因素,该同学进一步实验。取不同浓度CuCl2溶液,加入锌并振荡,均立刻产生少量气泡和红色固体,其他实验现象如下。
| 编号 | 浓度(rnol/L) | 试剂(锌均过量) | 实验现象 |
a | 0.5 | 锌片 | 立刻出现少量白色沉淀 | |
b | 1 | 锌片 | 立刻出现白色沉淀 | |
1 | 锌粉 | 立刻出现大量白色沉淀 | ||
d | 1 | 锌片、适量NaCl固体 | 少量白色沉淀,振荡迅速溶解 |
①对比实验a、b,实验结论是___。
②某同学从化学平衡的角度分析,d中白色沉淀溶解可能的原因是___(用离子方程式表示)。为证明该同学分析的原因正确,向b试管中加入适量___,振荡,观察到___,证明该同学分析的原因正确。
(4)利用沉淀法除去杂质在实际生产中应用广泛。
①在工业中冶炼锌,为了除去ZnSO4电解液溶液中的C1-,可加入___和___,生成沉淀而除去。
②通过进一步查阅资料得知:CuCl的形成与溶液的pH及Cu2+等离子浓度有关,一定条件下,通过实验得出pH、Cu2+浓度对Cl-沉淀的影响如图所示:
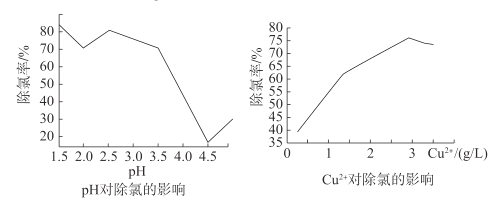
根据图,除去该电解液中Cl-的最佳条件是___。