题目内容
11.已知H-H键、Cl-Cl键和H-Cl键的键能分别为436kJ•mol-1、243kJ•mol-1和431kJ•mol-1,由此可知,由1mol Cl2和1mol H2生成2mol HCl的反应过程中( )| A. | 放热183 kJ | B. | 放热91.5 kJ | C. | 吸热183 kJ | D. | 吸热91.5 kJ |
分析 根据反应热=反应物总键能-生成物总键能计算Cl2(g)+H2(g)=2HCl(g)的热效应△H;
解答 解:H-H的键能为436kJ•mol-1、Cl-Cl键能为243kJ•mol-1、H-Cl键能为431kJ•mol-1,由于反应热=反应物总键能-生成物总键能,则:Cl2(g)+H2(g)=2HCl(g)热效应△H=436kJ•mol-1+243kJ•mol-1-2×431kJ•mol-1=-183 kJ•mol-1,所以放热183 kJ,
故选A.
点评 本题考查反应热的有关计算,难度不大,注意掌握键能与反应热的关系.

练习册系列答案
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案
相关题目
2.将5.6g铁粉投入盛有200mL 含0.1mol硫酸的烧杯中,2min 时铁粉刚好溶解完全.如果反应前后溶液的体积不变,则该反应的平均速率可表示为( )
| A. | v(Fe)=0.5 mol•L-1•min-1 | B. | v(H2SO4)=1 mol•L-1•min-1 | ||
| C. | v(H2)=0.25 mol•L-1•min-1 | D. | v(FeSO4)=0.25 mol•L-1•min-1 |
19.原电池产生电流的本质原因是( )
| A. | 原电池溶液中电解质能电离出自由移动的离子 | |
| B. | 有导线将两个活动性不同的电极连接 | |
| C. | 正极发生了氧化反应,负极发生了还原反应 | |
| D. | 电极上进行的氧化还原反应中有电子的转移 |
16.下列各组中两种微粒所含电子数不相等的是( )
| A. | F-和OH- | B. | Na+和Al3+ | C. | K+和Cl- | D. | Mg2+和S2- |
20.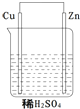 关于如图所示的原电池下列叙述正确的是( )
关于如图所示的原电池下列叙述正确的是( )
①电子由铜流向锌
②正极反应式为Cu+2e-=Cu2+
③SO42-向铜极移动
④铜电极上有气泡
⑤若有0.5mole-流经导线,则可产生0.25molH2
⑥烧杯中溶液的PH升高.
 关于如图所示的原电池下列叙述正确的是( )
关于如图所示的原电池下列叙述正确的是( )①电子由铜流向锌
②正极反应式为Cu+2e-=Cu2+
③SO42-向铜极移动
④铜电极上有气泡
⑤若有0.5mole-流经导线,则可产生0.25molH2
⑥烧杯中溶液的PH升高.
| A. | ①②③ | B. | ④⑤⑥ | C. | ①③⑤ | D. | ②④⑥ |
1.化学与生产、生活、社会密切相关,下列说法正确的是( )
| A. | 明矾[KAl(SO4)2•12H2O]溶于水会形成胶体,因此可用于自来水的杀菌消毒 | |
| B. | 煤燃烧时加入少量的生石灰可以减少废气中二氧化硫排放 | |
| C. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| D. | 聚氟乙烯是纯净物 |