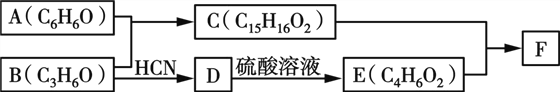
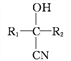
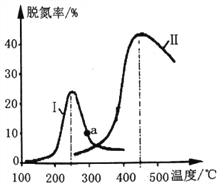
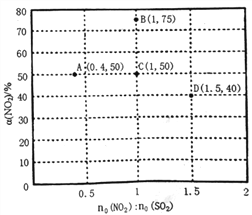
题目内容
【题目】把13g Zn放入足量的盐酸中,Zn完全反应。计算:
(1)13g Zn的物质的量___________
(2)参加反应的HCl的物质的量___________
(3)生成H2的体积(标准状况)___________
【答案】0.2mol 0.4mol 4.48L
【解析】
本题主要考查化学计量在化学方程式中的应用。根据n=![]() 计算13gZn的物质的量;根据方程式Zn+2HCl═ZnCl2+H2↑,计算参加反应n(HCl)、生成n(H2)以及标准状况下V(H2),由此分析解答。
计算13gZn的物质的量;根据方程式Zn+2HCl═ZnCl2+H2↑,计算参加反应n(HCl)、生成n(H2)以及标准状况下V(H2),由此分析解答。
(1)n=![]() =
=![]() =0.2mol;
=0.2mol;
(2)Zn+2HCl==ZnCl2+H2↑
1 2 1
0.2mol n(HCl) n(H2)
所以n(HCl)=2n(Zn)=0.4mol;
(3)由(2)可知,生成H2的物质的量n=0.2mol,其在标准状况下的体积![]() =0.2mol×22.4L/mol=4.48L。
=0.2mol×22.4L/mol=4.48L。

练习册系列答案
相关题目
【题目】用如下图装置实验,下列实验现象预期及相应结论均正确的是
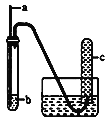
a | b | 实验现象预期 | 结论 | |
A | 铁丝 | HCl酸化的H2O2 | c中收集到无色气体 | 铁丝催化H2O2分解 |
B | 铜丝 | 浓硝酸 | c中收集到红棕色气体 | 硝酸有强氧化性 |
C | 生铁 | NaCl溶液 | 导管处发生倒吸 | 生铁发生吸氧腐蚀 |
D | 木条 | 浓硫酸 | 木条变黑 | 浓硫酸有强氧化性 |
A. A B. B C. C D. D