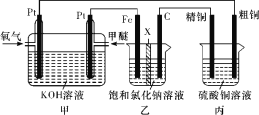
题目内容
【题目】下列事实不能用化学平衡移动原理解释的是
A.收集氯气可以用排饱和食盐水的方法
B.在一定条件下,氢气与碘蒸汽反应达平衡后,加压,混合气体颜色变深
C.可用浓氨水和氢氧化钠固体快速制取氨气
D.合成三氧化硫过程中使用过量的氧气,以提高二氧化硫的转化率
【答案】B
【解析】
利用勒夏特列原理的定义进行分析。
A、Cl2与H2O发生Cl2+H2O![]() H++Cl-+HClO,排饱和食盐水收集氯气,增加Cl-浓度,使平衡向逆反应方向进行,抑制Cl2的溶解,符合勒夏特列原理,故A不符合题意;
H++Cl-+HClO,排饱和食盐水收集氯气,增加Cl-浓度,使平衡向逆反应方向进行,抑制Cl2的溶解,符合勒夏特列原理,故A不符合题意;
B、H2和I2发生H2+I2![]() 2HI,组分都是气体,且反应前后气体系数之和相等,即增大压强平衡不移动,但组分浓度增大,颜色加深,故B符合题意;
2HI,组分都是气体,且反应前后气体系数之和相等,即增大压强平衡不移动,但组分浓度增大,颜色加深,故B符合题意;
C、浓氨水中存在NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-,加入NaOH固体,增加溶液中OH-的浓度,平衡向逆反应方向移动,NaOH固体遇水放出热量,使NH3逸出,故C不符合题意;
NH4++OH-,加入NaOH固体,增加溶液中OH-的浓度,平衡向逆反应方向移动,NaOH固体遇水放出热量,使NH3逸出,故C不符合题意;
D、2SO2+O2![]() 2SO3,使用过量的氧气,增加反应物的浓度,平衡向正反应方向移动,SO2的转化率提高,故D不符合题意;
2SO3,使用过量的氧气,增加反应物的浓度,平衡向正反应方向移动,SO2的转化率提高,故D不符合题意;
答案选B。

【题目】CO2和CO可作为工业合成甲醇(CH3OH)的直接碳源,还可利用CO2据电化学原理制备塑料,既减少工业生产对乙烯的依赖,又达到减少CO2排放的目的。
(1)利用CO2和H2反应合成甲醇的原理为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
上述反应常用CuO和ZnO的混合物作催化剂。相同的温度和时间段内,催化剂中CuO的质量分数对CO2的转化率和CH3OH的产率影响的实验数据如下表所示:
ω(CuO)/% | 10 | 20 | 30 | 4b | 50 | 60 | 70 | 80 | 90 |
CH3OH的产率 | 25% | 30% | 35% | 45% | 50% | 65% | 55% | 53% | 50% |
CO2的转化率 | 10% | 13% | 15% | 20% | 35% | 45% | 40% | 35% | 30% |
由表可知,CuO的质量分数为________催化效果最佳。
(2)利用CO和H2在一定条件下可合成甲醇,发生如下反应:CO(g)+2H2(g)![]() CH3OH(g),其两种反应过程中能量的变化曲线如下图a、b所示,下列说法正确的是(______)
CH3OH(g),其两种反应过程中能量的变化曲线如下图a、b所示,下列说法正确的是(______)
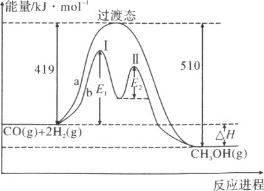
B.a反应正反应的活化能为510kJ·mol-1
C.b过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应
D.b过程使用催化剂后降低了反应的活化能和ΔH
E.b过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
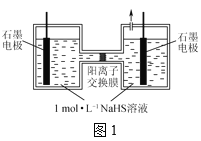
(3)①在1L的恒定密闭容器中按物质的量之比1︰2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化情况如图1所示,则压强P2________P1(填“>”、“<”或“=”);平衡由A点移至C点、D点移至B点,分别可采取的具体措施为________、________;在c点时,CO的转化率为________。
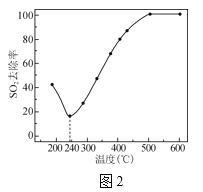
②甲和乙两个恒容密闭容器的体积相同,向甲中加入1molCO和2molH2,向乙中加入2molCO和4molH2,测得不同温度下CO的平衡转化率如图2所示,则L、M两点容器内压强:P(M)________2P(L);平衡常数:K(M)________K(L)。(填“>”、“<”或“=”)

(4)以纳米二氧化钛膜为工作电极,稀硫酸为电解质溶液,在一定条件下通入CO2进行电解,在阴极可制得低密度聚乙烯![]() (简称LDPE)。
(简称LDPE)。
①电解时,阴极的电极反应式是________。
②工业上生产1.4×102kg的LDPE,理论上需要标准状况下________L的CO2。