题目内容
12.从实验测得不同物质中氧氧之间的键长和键能的数据:| O-O键 数据 | O22- | O2- | O2 | O2+ |
| 键长(10-12 m) | 149 | 128 | 121 | 112 |
| 键能(kJ•mol-1) | x | y | z=494 | w=628 |
| A. | 成键的电子数越多,键能越大 | B. | 键长越长,键能越小 | ||
| C. | 成键所用的电子数越少,键能越大 | D. | 成键时电子对越偏移,键能越大 |
分析 根据表中数据以及题目信息键能大小的顺序是w>z>y>x,可知键长越短,键能越大;根据O22-和O2成键所用电子数分别为2、4个;O2和O2+电子数分别为16、15;
解答 解:A、O2和O2+电子数分别为16、15,但键能分别为:494kj/mol、628kj/mol,电子数越多键能越小,故A错误;
B、表中数据以及题目信息键能大小的顺序是w>z>y>x,可知键长越长,键能越小,故B正确;
C、O22-和O2成键所用电子数分别为2、4个,键能:z>x,成键所用电子数越少,键能越小,故C错误;
D、电子对偏移程度与键能无关,故D错误;
故选B.
点评 本题主要考查了键能的影响因素,难度不大,注意信息的掌握与运用.

练习册系列答案
相关题目
16.下列实验能获得成功的是( )
| A. | 苯和浓溴水用铁作催化剂制溴苯 | |
| B. | 氯乙烷与NaOH溶液共热,在水解后的溶液中直接加入AgNO3溶液检验Cl- | |
| C. | CH4与Cl2在光照条件下制备纯净的CH3Cl | |
| D. | 乙烯通入Br2的CCl4溶液中制备CH2Br-CH2Br |
3.碱式碳酸钴[Cox(OH)y(CO3)z]常用作电子材料、磁性材料的添加剂,受热时可分解生成三种氧化物.为了确定其组成,某化学兴趣小组同学设计了如图1所示的装置进行实验.
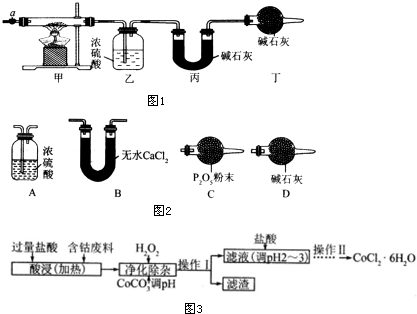
(1)请完成下列实验步骤:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
③加热甲中玻璃管,当乙装置中不再有气泡产生(填实验现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算.
(2)步骤④中缓缓通人空气数分钟的目的是将装置中生成的CO2和H2O全部排入乙、丙装置中.
(3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用图2装置中的D(填字母)连接在活塞a前(填装置连接位置).
(4)若按正确装置进行实验,测得如下数据.
则该碱式碳酸钴的化学式为Co2(OH)4(CO3)2.
(5)含有Co(AlO2)2的玻璃常用作实验室观察钾元素的焰色反应,该玻璃的颜色为蓝色.
(6)CoCl2•6H2O常用作多彩水泥的添加剂.以含钴废料(含少量Fe、Al等杂质)制取CoCl2•6H2O的一种工艺如图3:
已知:
①净化除杂时,加入 H2O2发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
②加入CoCO3 调pH为5.2~7.6,则操作1获得的滤渣成分为Fe(OH)3和Al(OH)3.
③加盐酸调整pH为2~3的目的为抑制CoCl2的水解.
④操作Ⅱ过程为蒸发浓缩、冷却结晶(填操作名称)、过滤.

(1)请完成下列实验步骤:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
③加热甲中玻璃管,当乙装置中不再有气泡产生(填实验现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算.
(2)步骤④中缓缓通人空气数分钟的目的是将装置中生成的CO2和H2O全部排入乙、丙装置中.
(3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用图2装置中的D(填字母)连接在活塞a前(填装置连接位置).
(4)若按正确装置进行实验,测得如下数据.
| 乙装置的质量/g | 丙装置的质量/g | |
| 加热前 | 80.00 | 62.00 |
| 加热后 | 80.36 | 62.88 |
(5)含有Co(AlO2)2的玻璃常用作实验室观察钾元素的焰色反应,该玻璃的颜色为蓝色.
(6)CoCl2•6H2O常用作多彩水泥的添加剂.以含钴废料(含少量Fe、Al等杂质)制取CoCl2•6H2O的一种工艺如图3:
已知:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
②加入CoCO3 调pH为5.2~7.6,则操作1获得的滤渣成分为Fe(OH)3和Al(OH)3.
③加盐酸调整pH为2~3的目的为抑制CoCl2的水解.
④操作Ⅱ过程为蒸发浓缩、冷却结晶(填操作名称)、过滤.
7.实验测得CO2为共价化合物,两个C=O键间的夹角为180°,以下判断正确的是( )
| A. | 由极性键构成的极性分子 | B. | 由极性键构成的非极性分子 | ||
| C. | 由非极性键构成的极性分子 | D. | CO2中C采取sp2杂化 |
17.下列有机物命名正确的是( )
| A. | 3,3-二甲基丁烷 | B. | 3-甲基-1-戊烯 | ||
| C. | 2,2-二甲基-1-戊烯 | D. | 3-甲基-2-乙基戊烷 |
4.中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是( )
| 选项 | 规律 | 结论 |
| A | 强氧化性物质可以用来杀菌消毒 | ClO2可用于自来水消毒 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硫酸,浓硫酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3沸点低于PH3 |
| D | 较强的酸可以制取较弱的酸 | 硫化氢通入硫酸铜溶液中不能反应 |
| A. | A | B. | B | C. | C | D. | D |
1.111号元素Rg所在周期和族是( )
| A. | 第七周期ⅠB族 | B. | 第七周期ⅡB族 | C. | 第六周期ⅠB族 | D. | 第六周期ⅡB族 |
2.下列关系正确的是( )
| A. | 沸点:戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷 | |
| B. | 密度:CCl4>CHCl3>H2O>苯 | |
| C. | 含氢质量分数:甲烷>乙烷>乙烯>乙炔>苯 | |
| D. | 同物质的量的物质燃烧耗O2量:已烷>环已烷>苯>苯甲酸 |