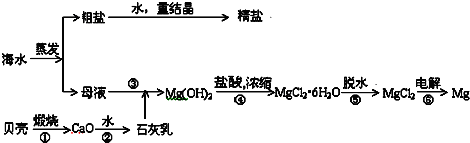
题目内容
17. 碳及其化合物在人类生产、生活中的应用非常广泛.“低碳生活”不再只是一种理想,更是一种值得期待的生活方式.
碳及其化合物在人类生产、生活中的应用非常广泛.“低碳生活”不再只是一种理想,更是一种值得期待的生活方式.(1)已知:
①2CH4(g)+3O2(g)?2CO(g)+4H2O(l)△H1=-1214.6kJ/mol
②2CO(g)+O2(g)?2CO2(g)△H2=-566kJ/mol,
则甲烷与氧气反应生成二氧化碳和液态水的热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ/mol.
(2)已知在恒温恒压下密闭容器的可逆反应CH4(g)+H2O(g)?CO(g)+3H2(g)
①该可逆反应一定达到平衡的标志是CD.
A.v(CH4)正=3v(H2)逆
B.水蒸气的浓度与一氧化碳的浓度相等
C.平均相对分子质量不随时间的变化而变化
D.密度不随时间的变化而变化
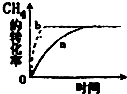
②该可逆反应在不同条件下,测得CH4转化率随时间变化如图所示,与实验a相比,b的实验条件是增加了催化剂.
分析 (1)①2CH4(g)+3O2(g)═2CO(g)+4H2O(l);△H1=-1214.6kJ/mol;
②2CO(g)+O2(g)?2CO2(g)△H2=-566kJ/mol,根据盖斯定律,①+②计算;
(2)①根据化学平衡状态的特征:正逆反应速率相等、各组分的浓度不随时间的变化而变化以及密度和平均相对分子质量的公式进行判断;
②根据影响化学反应速率以及平衡移动的因素来分析.
解答 解:(1)已知①2CH4(g)+3O2(g)═2CO(g)+4H2O(l);△H1=-1214.6kJ/mol;
②2CO(g)+O2(g)?2CO2(g)△H2=-566kJ/mol,
根据盖斯定律,①+②得2CH4(g)+4O2(g)═2CO2(g)+4H2O(l);△H=-1780.66kJ/mol;
所以甲烷燃烧热的热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ/mol,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ/mol;
(2)A.3v(CH4)正=v(H2)逆才能说明正逆反应速率相等,故A错误;
B.水蒸气的浓度与一氧化碳的浓度相等,不能说明达到了平衡,故B错误;
C.平均相对分子质量等于质量和物质的量的比值,质量守恒,但是物质的量是变化的,当平均相对分子质量不随时间的变化而变化,达到了平衡,故C正确;
D.根据ρ=$\frac{m}{V}$,质量守恒,恒温恒压下体积变化,所以密度变化,当密度不随时间的变化而变化,证明达到了平衡,故D正确;
故答案为:CD;
②CH4转化率随时间变化b曲线与实验a相比,反应速率加快了,但是平衡没变,所以是增加了催化剂的原因,故答案为:增加了催化剂.
点评 本题考查盖斯定律、化学平衡状态的判断以及图象有关问题,难度中等,注意对知识的理解与掌握,是对学生能力的考查.

①将32.2g Na2SO4.10H2O溶于少量水中,再加水稀释至100mL
②将14.2g Na2SO4溶于100mL水中
③将20mL 0.5mol/L Na2SO4溶液用水稀释至100mL.
| A. | ①② | B. | ②③ | C. | ①③ | D. | ①②③ |
| A. | 鸡蛋白溶液中加入食盐变浑浊 | B. | 用氯化汞消毒医疗器械 | ||
| C. | 用波尔多液杀菌 | D. | 用福尔马林对种子消毒 |
| A. | NaOH碱性比KOH强 | |
| B. | Li是最活泼的金属,F是最活泼的非金属 | |
| C. | X2+核外电子数目为18,则X在第四周期第ⅡA族 | |
| D. | 元素周期表有7个副族,7个主族,1个0族,1个Ⅷ族,共16个纵行 |

| A. | 分子中含有3种官能团 | B. | 可发生加成、取代、水解反应 | ||
| C. | 分子式为C7H6O5 | D. | 水溶液中羧基和羟基均能电离出H+ |
| A. | 把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 | |
| B. | 把铜片插入三氯化铁溶液中,在铜片表面出现一层铁 | |
| C. | 马口铁(镀锡铁)破损时与电解质溶液接触,铁先被腐蚀 | |
| D. | 把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
 用0.102 6mol•L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如下图所示,正确的读数为( )
用0.102 6mol•L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如下图所示,正确的读数为( )| A. | 22.40 mL | B. | 22.30 mL | C. | 23.65 mL | D. | 23.70 mL |