题目内容
4.a、b、c、d是短周期元素,周期表中a与b、b与c相邻;a与c的最外层电子数之比为2:3,b的最外层电子数比c的最外层电子数少1个;常见化合物d2c2与水反应生成c的单质,且溶液使酚酞试液变红.(1)a、b、c的氢化物稳定性顺序为(用分子式表示)H2O>NH3>CH4;b的氢化物和b的最高价氧化物的水化物反应生成Z,则Z中的化学键类型为离子键、共价键,Z的化合物类型(填离子化合物或共价化合物)为离子晶体化合物;
(2)d2c2与CO2反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2;
(3)一定量的d2c2与ac2反应后的固体物质,恰好与0.8mol稀盐酸溶液完全反应,并收集到0.25mol 气体.则用物质的量表示该固体物质的组成为0.1molNa2CO3、0.3molNa2O2.
分析 常见化合物d2c2与水反应生成c的单质,且溶液使酚酞试液变红,则d2c2为Na2O2,即d为Na,c为O;b的最外层电子数比c的最外层电子数少1个,则b为N或P,b与c相邻,则b为N;a与c的最外层电子数之比为2:3,则a的最外层电子数为4,a与b相邻,a为C,然后依据元素及其单质、化合物的性质来解答.
解答 解:a、b、c、d、e是短周期元素,常见化合物d2c2与水反应生成c的单质,且溶液使酚酞试液变红,则d2c2为Na2O2,即d为Na,c为O;b的最外层电子数比c的最外层电子数少1个,则b为N或P,b与c相邻,则b为N;a与c的最外层电子数之比为2:3,则a的最外层电子数为4,a与b相邻,a为C,
(1)非金属性O>N>C,则氢化物稳定性顺序为H2O>NH3>CH4,氨气和硝酸反应生成硝酸铵,铵根离子与硝酸根离子之间为离子键,非金属元素之间形成的为共价键,则硝酸铵为离子晶体,
故答案为:H2O>NH3>CH4;离子键、共价键;离子晶体;
(2)d2c2为Na2O2,d2c2与CO2反应的化学方程式为 2 Na2O2+2 CO2=2Na2CO3+O2,
故答案为:2 Na2O2+2 CO2=2Na2CO3+O2;
(3)过氧化钠与二氧化碳反应生成碳酸钠和氧气,则反应后的固体物质可能为碳酸钠或碳酸钠与过氧化钠的混合物,加入盐酸时发生的反应为Na2CO3+2HCl═2NaCl+H2O+CO2↑、2Na2O2+4HCl═4NaCl+2H2O+O2↑,
设Na2CO3、Na2O2的物质的量分别为x、y,则
$\left\{\begin{array}{l}{2x+2y=0.8\\;}\\{x+\frac{y}{2}=0.25}\end{array}\right.$,解得x=0.1mol,y=0.3mol,
故答案为:0.1molNa2CO3、0.3molNa2O2.
点评 本题考查位置、结构、性质的应用,明确过氧化钠与水的反应来推断元素是解答本题的关键,并熟悉化学键、晶体类型、利用化学反应方程式的计算等知识来解答,题目难度中等.

| A. | v(A)=0.01mol/(L•S) | B. | v(B)=0.02mol/(L•S) | C. | v(B)=0.60mol/(L•S) | D. | v(C)=1.0mol/(L•S) |
| A. | 原电池中电子流出的极为负极,发生氧化反应 | |
| B. | 原电池中阴离子向正极移动 | |
| C. | 原电池是将电能转化为化学能的装置 | |
| D. | 原电池正极上发生氧化反应 |
| A. | Li、Be、B原子最外层电子数逐渐增多 | |
| B. | P、S、Cl最高正价依次升高 | |
| C. | N、O、F得电子能力逐渐减弱 | |
| D. | Li、Na、K、Rb的金属性依次增强 |
| A. | Mg2+、Na+、Cl-、CO32- | B. | Fe2+、NO3-、Na+、Cl- | ||
| C. | NH4+、K+、AlO2-、SiO32- | D. | Cu2+、NH4+、SO42+、Na+ |
| A. | 物质的熔点:石英>食盐>冰>汞 | |
| B. | 热稳定性:PH3>H2S>HBr>NH3 | |
| C. | 微粒半径由大到小顺序是:H->Li+>H+ | |
| D. | 分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 |
(1)如图所示为其中的一种方法:

①用光电池电解水时,阳极的电极反应式为4OH--4e-═O2↑+2H2O.
②15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,则HOCH2CH2NH3Cl的水溶液显酸(填“酸”“碱”或“中”)性.
③已知,CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.5kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ•mol-1
则工业上以CO2(g)、H2(g)为原料合成CH3OH(l)的热化学方程式为CO2(g)+3H2(g)═CH3OH(l)+H2O(l)△H=-131.9 kJ•mol-1.
(2)将CO2转化为甲醚的反应原理为2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(l)
①在恒温、恒容的密闭容器中,下列描述能说明上述反应已达化学平衡状态的是bd(填序号).
a.生成1mol CH3OCH3(g)的同时,生成3mol H2O(l)
b.体系中混合气体的密度不随时间而变化
c.体系中CO2与H2的体积比为1:3
d.体系中的气体的总压强不随时间而变化
②已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
| 投料比$\frac{n{H}_{2}p}{nC{O}_{2}p}$ | 500K | 600K | 700K |
| 1.5 | 45% | 33% | 20% |
| x | a | b | c |
③在一定温度下,向体积为0.5L的密闭容器中加入2mol CO2和6mol H2,20min后达到平衡,测得平衡时CH3OCH3为0.5mol,则该反应的反应速率v(CO2)=0.1mol•L-1•min-1,H2的转化率α(H2)=50%;加入催化剂,v(CO2)增大(填“增大”、“减小”或“不变”,下同),α(H2)不变.
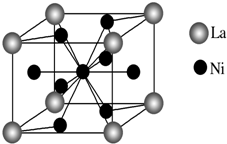 金属镍及其化合物在合金材料以及催化剂等方面应用广泛,请回答下列问题.
金属镍及其化合物在合金材料以及催化剂等方面应用广泛,请回答下列问题.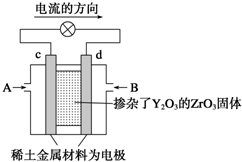 科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空.如下图所示装置中,以稀土金属材料作惰性电极,在两极上分别通入丙烷和空气,其中固体电解质是掺杂了Y2O3的ZrO3固体,它在高温下能传导正极生成的O2-.
科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空.如下图所示装置中,以稀土金属材料作惰性电极,在两极上分别通入丙烷和空气,其中固体电解质是掺杂了Y2O3的ZrO3固体,它在高温下能传导正极生成的O2-.