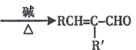
题目内容
【题目】根据下列图示得出的结论不正确的是( )
A.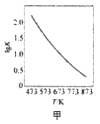 图甲是CO(g)+H2O(g)
图甲是CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的△H<0
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的△H<0
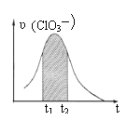
B.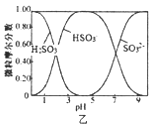 图乙是向Na2CO3溶液中通入SO2过程中部分微粒摩尔分数与pH的关系曲线,用该方法制备NaHSO3,当pH=4时应停止通入SO2
图乙是向Na2CO3溶液中通入SO2过程中部分微粒摩尔分数与pH的关系曲线,用该方法制备NaHSO3,当pH=4时应停止通入SO2
C. 图丙是常温下等体积盐酸和氨水稀释时溶液导电性与体积变化的曲线,图中pH大小关系为c>b>d
图丙是常温下等体积盐酸和氨水稀释时溶液导电性与体积变化的曲线,图中pH大小关系为c>b>d
D.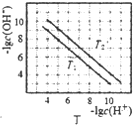 图丁表示不同温度下水溶液中-lgc(H+)、-lgc(OH-)的变化曲线,图中T1>T2
图丁表示不同温度下水溶液中-lgc(H+)、-lgc(OH-)的变化曲线,图中T1>T2
【答案】C
【解析】
A.根据图知,升高温度,化学平衡常数减小,说明平衡逆向,升高温度平衡向吸热方向移动,则逆反应是吸热反应,正反应是放热反应,即正反应△H<0,故A正确;
B.根据图象分析,pH=4时,溶液中主要存在为HSO3-,所以当pH=4时应停止通入SO2,控制pH,主要得到NaHSO3,故B正确;
C.盐酸溶液pH小于一水合氨,稀释过程中盐酸溶液pH增大,溶液的pH大小关系:b>d>c,故C错误;
D.-lgc(H+)、-lgc(OH-)的乘积越大,水的电离程度越小,可知T1<T2,故D正确,
故选:C。

练习册系列答案
相关题目