题目内容
20.实验室在保存FeCl2溶液时为了防止FeCl2溶液变质,经常向其中加入铁粉,所发生的化学方程式是Fe+2FeCl3=3FeCl2.分析 Fe与氯化铁反应生成氯化亚铁,以此来解答.
解答 解:保存FeCl2溶液时为了防止FeCl2溶液变质,经常向其中加入铁粉,所发生的化学方程式是Fe+2FeCl3=3FeCl2,故答案为:Fe+2FeCl3=3FeCl2.
点评 本题考查铁及其化合物的性质,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重氧化还原反应应用的考查,题目难度不大.

练习册系列答案
相关题目
10.5.4g M和16.0g N恰好完全反应,生成0.2mol X和10.2gY,则X的摩尔质量为( )
| A. | 56 | B. | 56 g•mol-1 | C. | 28 | D. | 28 g•mol -1 |
11.下列关于Na2CO3固体和NaHCO3固体性质的有关叙述中不正确的是( )
| A. | 在水中溶解性:Na2CO3>NaHCO3 | |
| B. | 热稳定性:Na2CO3>NaHCO3 | |
| C. | 与相同浓度的盐酸反应的速度:Na2CO3>NaHCO3 | |
| D. | Na2CO3与NaHCO3可以相互转化 |
8.根据如图海水综合利用的工业流程图,判断下列说法正确的是( )
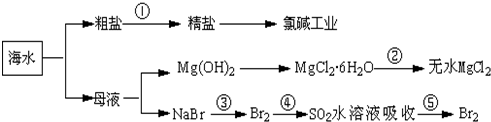

| A. | 除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 在过程④中SO2被还原 | |
| C. | 从第③步到第⑤步的目的是为了浓缩 | |
| D. | 从能量转换角度看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程 |
15.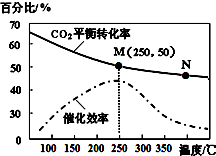 一定条件下合成乙烯:6H2(g)+2CO2(g)$\stackrel{催化剂}{?}$CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )
一定条件下合成乙烯:6H2(g)+2CO2(g)$\stackrel{催化剂}{?}$CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )
 一定条件下合成乙烯:6H2(g)+2CO2(g)$\stackrel{催化剂}{?}$CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )
一定条件下合成乙烯:6H2(g)+2CO2(g)$\stackrel{催化剂}{?}$CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )| A. | 该反应的逆反应为吸热反应 | |
| B. | 平衡常数:KM>KN | |
| C. | 生成乙烯的速率:v(N)一定大于v(M) | |
| D. | 当温度高于250℃,升高温度,催化剂的催化效率降低 |
5.下列关于12C和13C微粒的说法中正确的是( )
| A. | 它们是同种元素 | B. | 它们的化学性质不同 | ||
| C. | 它们是同位素关系 | D. | 它们是同种原子 |
12.若将6mol氢气和1mol氮气充入到某密闭容器中发生反应N2(g)+3H2(g)?2NH3(g).那么下列各百分数中,可能是氢气的转化率的是( )
| A. | 40% | B. | 50% | C. | 80% | D. | 100% |
18.在蒸发皿中蒸发液体,下列操作不正确的是( )
| A. | 直接用酒精灯的外焰加热蒸发皿 | |
| B. | 加热过程中不断用玻璃棒搅拌 | |
| C. | 加热到液体全部消失 | |
| D. | 蒸发皿中出现多量晶体、少量液体时,停止加热,利用蒸发皿的余热烘干 |