题目内容
3. 某研究性学习小组对Zn跟一定量的浓硫酸反应生成的气体产物进行探究.
某研究性学习小组对Zn跟一定量的浓硫酸反应生成的气体产物进行探究.【提出假设】:
小组同学经过分析讨论认为生成气体可能含H2和SO2.
【设计实验方案,验证假设】主要包括两个环节:
Ⅰ.验证SO2,实验装置如图所示;
Ⅱ.检验产物中含有H2,实验内容将由B部分导出的气体依次通过装置C、D、E、F、G.Ⅱ中装置C、D、E、F、G的信息如表所示:
| 仪器标号 | C | D | E | F | G |
| 仪器 | 洗气瓶 | 洗气瓶 | 硬质玻璃管,加热 | 干燥管 | 干燥管 |
| 仪器中所加物质 | NaOH溶液 | 浓硫酸 | CuO粉末 | 试剂X | 无水CaCl2固体 |
(1)小组同学认为生成气体中含H2的理由是随着反应的进行,硫酸的浓度变小;
(2)盛放锌粒的仪器名称是蒸馏烧瓶;
(3)B部分装置的目的是验证SO2并探究SO2与品红作用的可逆性,实验的操作及主要现象是品红溶液先褪色,加热后又恢复红色;
(4)①装置D、G的作用依次是干燥H2,防止干扰后面H2的检验、防止空气中的水蒸气进入H;
②E中发生反应的化学方程式是CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O;
③试剂X是无水CuSO4粉末.
分析 (1)随着反应的进行,浓硫酸变成稀硫酸后,锌与稀硫酸反应会生成氢气;
(2)根据仪器的构造写出其名称;
(3)二氧化硫漂白品红溶液的现象为暂时的,加热后能够恢复;
(4)①E中氧化铜与氢气发生反应生成水,然后通过检验水证明混合气体中含有氢气,所以气体加入H前必须干燥;装置E是用于检验水的,所以应该避免空气中的水分加入H;
②E中氢气与氧化铜反应生成铜和水,据此写出反应的化学方程式;
③干燥管中X是用于检验是否有水生成的,应该为无水硫酸铜.
解答 解:(1)随着反应的进行,硫酸的浓度变小,稀硫酸与锌反应生成硫酸锌和氢气,所以生成的氢气中会含有氢气,
故答案为:随着反应的进行,硫酸的浓度变小;
(2)根据图示仪器构造可知,盛放锌的仪器名称为蒸馏烧瓶,
故答案为:蒸馏烧瓶;
(3)二氧化硫与有色物质生成不稳定的无色物质,该无色物质不稳定,加热后会分解,所以品红溶液先褪色,加热后又恢复红色,
故答案为:品红溶液先褪色,加热后又恢复红色;
(4)①本实验需要通过检验氢气与氧化铜反应的水判断氢气的存在情况,所以气体必须是干燥的,应该用浓硫酸干燥;试剂X应该为无水硫酸铜,用于检验水,则应该避免空气中水蒸气加入H,干扰实验,
故答案为:干燥H2,防止干扰后面H2的检验;防止空气中的水蒸气进入H;
②装置E中氢气与氧化铜反应生成铜和水,反应的化学方程式为:CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O,
故答案为:CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O;
③干燥管F中试剂X是检验是否有水生成,所以试剂X为无水CuSO4粉末,
故答案为:无水CuSO4粉末.
点评 本题考查了浓硫酸的性质,题目难度中等,注意掌握锌与浓硫酸、稀硫酸的反应原理的区别,明确常见气体的性质及检验方法,试题培养了学生的分析能力及化学实验能力.

| A. | ${\;}_{\;}^{18}$O ${\;}_{\;}^{31}$P ${\;}_{\;}^{119}$Sn | |
| B. | ${\;}_{\;}^{27}$Al ${\;}_{\;}^{19}$F ${\;}_{\;}^{12}$C | |
| C. | 元素周期表中V A族所有元素的原子 | |
| D. | 元素周期表中第一周期所有元素的原子 |
Ⅰ、工业上一般以铁矿石、焦炭、石灰石和空气等为原料在高炉中炼制生铁
(1)高炉炼铁过程中加入石灰石的主要目的是将矿石中的二氧化硅等转变为炉渣.
(2)写出在高炉中铁矿石(以磁铁矿为例)被还原成单质铁的化学方程式Fe3O4+4CO$\frac{\underline{\;\;△\;\;}}{\;}$3Fe+4CO2.
Ⅱ、碱式硫酸铁[Fe(OH)SO4]是一种用语污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁)生产碱式硫酸铁的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(4)加入少量NaHCO3的目的是调节溶液的pH,应控制pH的范围区间为[4.4~7.5).
(5)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若通入2.8LO2(标准状况),则相当于节约NaNO2的质量为34.5g.
(6)碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe(OH)SO4]2-聚合离子,该水解反应的离子方程式为2[Fe(OH)]2++2H2O═[Fe2(OH)4]2++2H+.
Ⅲ、铁的化合物也是制备高能锂电池的重要材料,已知LiFePO4电池反应为FePO4+Li$\frac{放电}{充电}$LiFePO4,电池中的固体电解质可传到Li+写出该电池充电时阳极反应式LiFePO4-e-═FePO4+Li+,常温下以该电池为电源电解500mL饱和食盐水,当消耗0.35gLi时,溶液的pH值为13(忽略溶液的体积变化).
| A. | 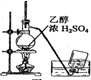 制备乙烯 | B. | 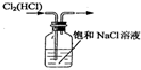 除去Cl2中的HCl | ||
| C. | 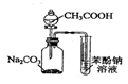 证明酸性:CH3COOH>H2CO3>苯酚 | D. | 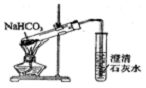 探究NaHCO3的热稳定性 |
| A. | 水冷却到0℃以下时变成冰,是因为水分子从液体变成了固体 | |
| B. | 所有物质在温度变化时都能表现出三态变化 | |
| C. | 不降低温度,只增大压强,也可能使物质从气态变成固态 | |
| D. | 物质能热胀冷缩是因为构成物质的微粒能够热胀冷缩 |
| 选项 | 操作 | 现象 | 结论 |
| A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸有脱水性和强氧化性 |
| B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al浓硝酸不反应 |
| C | 将盐酸滴入NaOH溶液 | 无现象 | 盐酸与氢氧化钠不反应 |
| D | 将水蒸气通过灼热铁粉 | 粉末变红 | 铁水在高温下发生反应 |
| A. | A | B. | B | C. | C | D. | D |
 ,其中含氧官能团名称是羟基.
,其中含氧官能团名称是羟基.
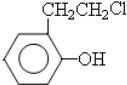 ,
,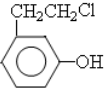 .
.