题目内容
2.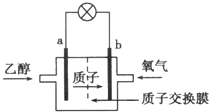 在2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇(CH3OH)电池效率高出32倍,且更安全.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意图如图所示,下列说法中正确的是( )
在2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇(CH3OH)电池效率高出32倍,且更安全.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意图如图所示,下列说法中正确的是( )| A. | a极为电池的正极 | |
| B. | 电池工作时电子由b极沿导线经灯泡再到a极 | |
| C. | 电池正极的电极反应为:4H++O2+4e-=2H2O | |
| D. | 电池工作时,1 mol乙醇被氧化时就有6 mol电子转移 |
分析 该燃料电池中,通入燃料乙醇的电极是负极,则a是负极,通入氧化剂氧气的电极b是正极,电解质溶液呈酸性,则负极反应式为C2H5OH+3H2O-12e-=2CO2+12H+,正极氧气得到电子被还原,电极反应式为4H++O2+4e-=2H2O,据此分析解答.
解答 解:A.燃料电池中通入氧化剂的电极是正极,通入燃料的电极是负极,则a极为原电池负极、b极是正极,故A错误;
B.放电时,电子从负极沿导线流向正极,a是负极、b是正极,则电池工作时电子由a极沿导线经灯泡再到b极,故B错误;
C.放电时,正极上氧气得电子发生还原反应,电极反应式为:4H++O2+4e-=2H2O,故C正确;
D.电池工作时,根据C2H5OH+3H2O-12e-=2CO2+12H+知,1 mol乙醇被氧化时就有12 mol电子转移,故D错误;
故选C.
点评 本题考查化学电源新型电池,为高考高频点,所有燃料电池中负极上都是燃料失电子发生氧化反应,会正确书写电极反应式,要结合电解质溶液酸碱性书写,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 在酒精灯上加热铝箔 | 铝箔熔化但不滴落 | 熔点:铝>氧化铝 |
| B | 某酸雨试样中加入Ba(OH)2溶液 | 产生白色沉淀 | 酸雨试样中只含SO42- |
| C | 用玻璃棒蘸取浓硫酸点到蓝色石蕊试纸上 | 试纸变黑 | 浓硫酸具有脱水性 |
| D | 食用加碘盐加入食醋和KI溶液,再加入CCl4振荡,静置 | 下层呈紫红色 | 该食用加碘盐含有KIO3 |
| A. | A | B. | B | C. | C | D. | D |
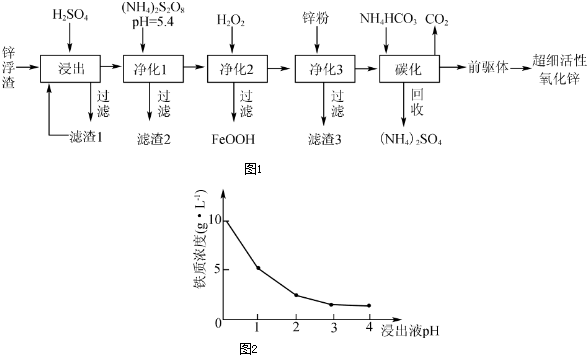
17.铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.
Ⅰ、工业上一般以铁矿石、焦炭、石灰石和空气等为原料在高炉中炼制生铁
(1)高炉炼铁过程中加入石灰石的主要目的是将矿石中的二氧化硅等转变为炉渣.
(2)写出在高炉中铁矿石(以磁铁矿为例)被还原成单质铁的化学方程式Fe3O4+4CO$\frac{\underline{\;\;△\;\;}}{\;}$3Fe+4CO2.
Ⅱ、碱式硫酸铁[Fe(OH)SO4]是一种用语污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁)生产碱式硫酸铁的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(3)写出反应Ⅰ中发生的置换反应的离子方程式Fe+2H+═Fe2++H2↑.
(4)加入少量NaHCO3的目的是调节溶液的pH,应控制pH的范围区间为[4.4~7.5).
(5)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若通入2.8LO2(标准状况),则相当于节约NaNO2的质量为34.5g.
(6)碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe(OH)SO4]2-聚合离子,该水解反应的离子方程式为2[Fe(OH)]2++2H2O═[Fe2(OH)4]2++2H+.
Ⅲ、铁的化合物也是制备高能锂电池的重要材料,已知LiFePO4电池反应为FePO4+Li$\frac{放电}{充电}$LiFePO4,电池中的固体电解质可传到Li+写出该电池充电时阳极反应式LiFePO4-e-═FePO4+Li+,常温下以该电池为电源电解500mL饱和食盐水,当消耗0.35gLi时,溶液的pH值为13(忽略溶液的体积变化).
Ⅰ、工业上一般以铁矿石、焦炭、石灰石和空气等为原料在高炉中炼制生铁
(1)高炉炼铁过程中加入石灰石的主要目的是将矿石中的二氧化硅等转变为炉渣.
(2)写出在高炉中铁矿石(以磁铁矿为例)被还原成单质铁的化学方程式Fe3O4+4CO$\frac{\underline{\;\;△\;\;}}{\;}$3Fe+4CO2.
Ⅱ、碱式硫酸铁[Fe(OH)SO4]是一种用语污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁)生产碱式硫酸铁的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(4)加入少量NaHCO3的目的是调节溶液的pH,应控制pH的范围区间为[4.4~7.5).
(5)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若通入2.8LO2(标准状况),则相当于节约NaNO2的质量为34.5g.
(6)碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe(OH)SO4]2-聚合离子,该水解反应的离子方程式为2[Fe(OH)]2++2H2O═[Fe2(OH)4]2++2H+.
Ⅲ、铁的化合物也是制备高能锂电池的重要材料,已知LiFePO4电池反应为FePO4+Li$\frac{放电}{充电}$LiFePO4,电池中的固体电解质可传到Li+写出该电池充电时阳极反应式LiFePO4-e-═FePO4+Li+,常温下以该电池为电源电解500mL饱和食盐水,当消耗0.35gLi时,溶液的pH值为13(忽略溶液的体积变化).
14.以下实验装置正确,且能达到实验目的是( )
| A. | 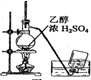 制备乙烯 | B. | 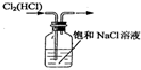 除去Cl2中的HCl | ||
| C. | 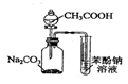 证明酸性:CH3COOH>H2CO3>苯酚 | D. | 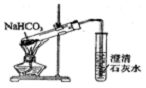 探究NaHCO3的热稳定性 |
8.下列说法中正确的是( )
| A. | 水冷却到0℃以下时变成冰,是因为水分子从液体变成了固体 | |
| B. | 所有物质在温度变化时都能表现出三态变化 | |
| C. | 不降低温度,只增大压强,也可能使物质从气态变成固态 | |
| D. | 物质能热胀冷缩是因为构成物质的微粒能够热胀冷缩 |
9.室温下,0.1mol/L的二元酸H2A溶液中,溶液体系可能存在的含A粒子(H2A、HA-、A2-)所占物质的量分数随pH变化的关系如图所示,下列说法正确的是( )
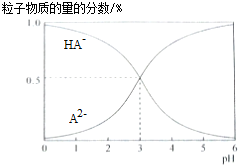

| A. | H2A的电离方程式为:H2A?H++HA- | |
| B. | pH=5时,在NaHA和Na2A的混合溶液中:c(HA-):c(A2-)=1:100 | |
| C. | 等物质的量浓度的NaHA和Na2A溶液等体积混合,离子浓度大小关系为c(Na+)>c(HA-)>c(A2-) | |
| D. | Na2A溶液必存在c(OH-)=c(H+)+c(HA-)+2c(H2A),各粒子浓度均大于0 |
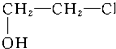 ②
② ③CH2Cl2 ④CCl4.
③CH2Cl2 ④CCl4.