题目内容
实验室中需要220mL0.5mol/L H2SO4,现用98%浓硫酸(密度为1.84g/cm3)稀释配制.
(1)本实验室中需要的容器是 .
(2)要将浓硫酸在 中稀释,稀释时的操作方法是 .
(3)必须将稀释后的硫酸 后再移液,原因是 ,否则,所配制的稀硫酸浓度会 (偏高、偏低、无影响).
(1)本实验室中需要的容器是
(2)要将浓硫酸在
(3)必须将稀释后的硫酸
考点:配制一定物质的量浓度的溶液
专题:物质的量浓度和溶解度专题
分析:(1)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器;
(2)根据浓硫酸的稀释方法、注意事项进行分析解答即可.
(3)根据浓硫酸稀释放热,热溶液的体积大,冷却下来体积偏小,即溶液的体积偏小,影响溶液的浓度.
(2)根据浓硫酸的稀释方法、注意事项进行分析解答即可.
(3)根据浓硫酸稀释放热,热溶液的体积大,冷却下来体积偏小,即溶液的体积偏小,影响溶液的浓度.
解答:
解:(1)配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取(用到胶头滴管)称量,在烧杯中稀释,冷却后转移到250L容量瓶中(容量瓶没有220mL),并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:量筒、烧杯、玻璃棒、胶头滴管、250mL容量瓶.
故答案为:量筒、烧杯、玻璃棒、胶头滴管、250mL容量瓶.
(2)稀释浓硫酸时,要把浓硫酸缓缓地沿烧杯内壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散;
故答案为:烧杯;浓硫酸缓缓地沿烧杯内壁注入水中,并及时搅拌和冷却.
(3)浓硫酸稀释放热,热溶液的体积大,一旦冷却下来体积偏小,浓度偏大,所以必须冷却至室温才能转移至容量瓶;
故答案为:冷却至室温;浓硫酸溶于水放热;偏高.
故答案为:量筒、烧杯、玻璃棒、胶头滴管、250mL容量瓶.
(2)稀释浓硫酸时,要把浓硫酸缓缓地沿烧杯内壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散;
故答案为:烧杯;浓硫酸缓缓地沿烧杯内壁注入水中,并及时搅拌和冷却.
(3)浓硫酸稀释放热,热溶液的体积大,一旦冷却下来体积偏小,浓度偏大,所以必须冷却至室温才能转移至容量瓶;
故答案为:冷却至室温;浓硫酸溶于水放热;偏高.
点评:本题考查了一定物质的量浓度溶液的配制步骤以及误差分析,难度不大,注意掌握浓硫酸的稀释方法、注意事项.

练习册系列答案
相关题目
下列电子式或结构式错误的是( )
A、OH-的电子式  |
B、NH4Br的电子式 |
C、CCl4的电子式  |
| D、H2O的结构式H-O-H |
分子式为C4H10的烷烃与氯气发生取代反应生成一氯代物的同分异构体的数目有( )
| A、2种 | B、3种 | C、4种 | D、5种 |
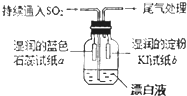 SiO2、SO2、NaOH、H2O、卤素及其化合物是中学化学中的常见物质,他们在生产、生活中有着广泛的应用,请回答下列有关问题:
SiO2、SO2、NaOH、H2O、卤素及其化合物是中学化学中的常见物质,他们在生产、生活中有着广泛的应用,请回答下列有关问题: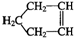 可简写为:
可简写为: 降冰片烯的分子结构可表示为:
降冰片烯的分子结构可表示为: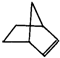 (1)降冰片烯的分子式为
(1)降冰片烯的分子式为