题目内容
有A、B、C、D四种无色可溶性盐,分别是由Na+、K+、Ag+、Ba2+、Cl-、CO32-、SO32-、NO3-中的不同离子组成(离子不能重复使用).A溶液与稀硫酸混合产生无色无味的气体,B溶液与稀硫酸混合产生能使品红褪色的气体且焰色反应为黄色,C溶液与稀盐酸混合有沉淀生成.
(1)写出下列物质的化学式A ,B ,C ,D .
(2)写出下列反应的离子方程式:
①C溶液与足量稀盐酸反应:
②B溶液与足量氯化铁溶液反应:
③A溶液与足量氢氧化钡溶液反应: .
(1)写出下列物质的化学式A
(2)写出下列反应的离子方程式:
①C溶液与足量稀盐酸反应:
②B溶液与足量氯化铁溶液反应:
③A溶液与足量氢氧化钡溶液反应:
考点:常见离子的检验方法,无机物的推断
专题:
分析:给出八种离子形成四种可溶性盐,这个可以通过一一组合的形式确定可能存在的物质,之后结合实验现象进行继续排除,从而最终确定,A溶液与稀硫酸混合产生无色无味的气体,说明A中含有CO3 2-,B溶液与稀硫酸混合产生能使品红褪色的气体且焰色反应为黄色,则说明B中含有SO32-和Na+,则B为Na2SO3,所以A中含有阳离子为K+,因为其它阳离子与碳酸根结合不溶于水,所以A为K2CO3,在Ag+、Ba2+、Cl-、NO3-中要形成两种可溶性盐,则它们的组合只能是BaCl2和AgNO3,C溶液与稀盐酸混合有沉淀生成,所以C为AgNO3,D为BaCl2,据此答题.
解答:
解:给出八种离子形成四种可溶性盐,这个可以通过一一组合的形式确定可能存在的物质,之后结合实验现象进行继续排除,从而最终确定,A溶液与稀硫酸混合产生无色无味的气体,说明A中含有CO3 2-,B溶液与稀硫酸混合产生能使品红褪色的气体且焰色反应为黄色,则说明B中含有SO32-和Na+,则B为Na2SO3,所以A中含有阳离子为K+,因为其它阳离子与碳酸根结合不溶于水,所以A为K2CO3,在Ag+、Ba2+、Cl-、NO3-中要形成两种可溶性盐,则它们的组合只能是BaCl2和AgNO3,C溶液与稀盐酸混合有沉淀生成,所以C为AgNO3,D为BaCl2,
(1)因A为K2CO3;B为Na2SO3;C为AgNO3;D为BaCl2;故答案为:K2CO3;Na2SO3;AgNO3;BaCl2;
(2)AgNO3与盐酸反应的离子方程式为:Ag++Cl-=AgCl↓;
Na2SO3和FeCl3反应的离子方程式为:2Fe3++SO32-+H2O═2Fe2++SO42-+2H+;
K2CO3和氢氧化钡溶液反应的离子方程式为:Ba2++CO32-═BaCO3↓;
故答案为:Ag++Cl-=AgCl↓;2Fe3++SO32-+H2O═2Fe2++SO42-+2H+;Ba2++CO32-═BaCO3↓.
(1)因A为K2CO3;B为Na2SO3;C为AgNO3;D为BaCl2;故答案为:K2CO3;Na2SO3;AgNO3;BaCl2;
(2)AgNO3与盐酸反应的离子方程式为:Ag++Cl-=AgCl↓;
Na2SO3和FeCl3反应的离子方程式为:2Fe3++SO32-+H2O═2Fe2++SO42-+2H+;
K2CO3和氢氧化钡溶液反应的离子方程式为:Ba2++CO32-═BaCO3↓;
故答案为:Ag++Cl-=AgCl↓;2Fe3++SO32-+H2O═2Fe2++SO42-+2H+;Ba2++CO32-═BaCO3↓.
点评:本题主要考查了溶液中离子共存的问题,解题是要注意元素化合物知识的灵活运用,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列有机实验操作或叙述正确的是( )
| A、将乙烯和乙炔气体分别通入溴的四氯化碳溶液中前者褪色,后者不褪色 |
| B、鉴别乙烷和乙炔可将二者分别通入酸性高锰酸钾溶液中 |
| C、苯能使溴水褪色是因为二者反应生成了溴苯 |
| D、工业上制备氯乙烯可用乙炔在一定条件下与氯化氢发生取代反应 |
已知乙烯为平面结构,因此1,2-二氯乙烯可以形成两种不同的空间异构体: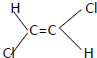 和
和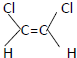 .下列各物质中,能形成类似上述两种空间异构体的是( )
.下列各物质中,能形成类似上述两种空间异构体的是( )
 和
和 .下列各物质中,能形成类似上述两种空间异构体的是( )
.下列各物质中,能形成类似上述两种空间异构体的是( )| A、1,1-二氯乙烯 |
| B、2-甲基-2-戊烯 |
| C、3-甲基-2-戊烯 |
| D、1-戊烯 |


 水解反应(取代反应)A、B、C、D均为含苯环的有机物,且相对分子质量B>A>C.已知有机物A的结构简式为
水解反应(取代反应)A、B、C、D均为含苯环的有机物,且相对分子质量B>A>C.已知有机物A的结构简式为