题目内容
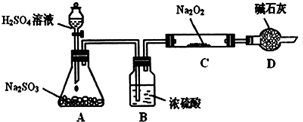
Ⅰ.(1)某兴趣小组甲设计了以下装置和方法测定空气中SO2含量。你认为可行的操作是 (填序号)
| 序号 | A | B | C |
| 装置 |  |  |  |
| 原理 | 通入V升空气,测定生成沉淀的质量 | 当KMnO4溶液刚好褪色时,测定通入空气的体积V | 通入V升空气,测定U型管增加的质量 |
(2)兴趣小组乙取336mL(标准状况)某由SO2和N2组成的混合气体Y,将其通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由此推知气体Y中SO2的体积分数为 。
Ⅱ某化学兴趣小组丙为探究Fe3+是否能氧化SO2,设计了如下实验装置。

(1)如上图连接好装置。实验前应进行 操作
(2)观察到装置C中产生了白色沉淀,同学们提出了以下猜想(每个猜想只考虑一种物质的氧化性)。
猜想1: ;
猜想2:SO2被Fe3+氧化了;
猜想3:SO2被NO3—氧化了
(3)甲同学认为猜想1正确,并利用上述装置A进行了排除干扰的探究实验。
(4)乙同学认为猜想2正确,则装置C中反应的离子方程式是
(5)丙同学认为猜想3正确,他利用甲同学的实验装置,设计实验验证猜想。请在答题卡上写出实验步骤以及预期现象和结论。限选实验试剂:NaNO3溶液、KSCN溶液、FeCl3溶液、BaCl2溶液、
| 实验步骤 | 预期现象和结论 |
| | |
Fe(NO3)3溶液
Ⅰ(1)B (2)66.7%
Ⅱ(1)检查装置的气密性 (2)空气与SO2进入H2O中,生成了H2SO4
(4)SO2 + 2Fe3+ + Ba2+ + 2H2O=BaSO4↓+ 2Fe2+ + 4H+
(5)实验步骤 预期现象和结论 将装置C中的溶液换为NaNO3和BaCl2的混合溶液,
然后打开分液漏斗活塞进行反应反应一段时间后,若C中出现白色沉淀,则证明猜想3正确
解析试题分析:Ⅰ.(1)A中通入二氧化硫气体不会生成沉淀,故错误。B中二氧化硫和高锰酸钾反应生成了硫酸根,紫色褪色,可以检测,正确;空气中含有二氧化碳也会与碱石灰反应,错误;(2)兴趣小组乙取336mL(标准状况)某由SO2和N2组成的混合气体Y,将其通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由此推知气体Y中SO2的体积分数为SO2具有还原性,通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4,离子方程式的书写,将产物中的氢溴酸和硫酸拆成离子,所以离子方程式为SO2+Br2+2H2O═2Br-+SO42-+4H+,生成的硫酸遇到氯化钡会产生白色沉淀,可以先洗涤然后再过滤来获得纯净的硫酸钡沉淀,则n(混合气体)=0.336L/22.4=0.015mol, 则 SO2的体积分数:0.01/0.015=66.7%。(1)如上图连接好装置。实验前应进行检查装置的气密性 操作。
则 SO2的体积分数:0.01/0.015=66.7%。(1)如上图连接好装置。实验前应进行检查装置的气密性 操作。
(2)根据可会把SO2氧化为正6价的硫,还有可能是空气中的氧气,故猜想1: 空气与SO2进入H2O中,生成了H2SO4。
(3)甲同学认为猜想1正确,并利用上述装置A进行了排除干扰的探究实验。
(4)根据氧化还原反应原理,由于三价铁离子有强氧化性能把二氧化硫转化为硫酸根离子,则装置C中反应的离子方程式是SO2 + 2Fe3+ + Ba2+ + 2H2O=BaSO4↓+ 2Fe2+ + 4H+ 。
(5)只要把三价铁离子不要引入这样就会避免干扰就行,故可选实验试剂:NaNO3溶液BaCl2溶液进行实验,将装置C中的溶液换为NaNO3和BaCl2的混合溶液,然后打开分液漏斗活塞进行反应。反应一段时间后,若C中出现白色沉淀,则证明猜想3正确。
考点:本题考查铁及其化合物的性质实验,结合相关的化学反应原理是解答的关键,本题难度中等。

 阅读快车系列答案
阅读快车系列答案苯甲酸是一种重要的化工产品,某学习小组设计方案制备苯甲酸。反应原理如下: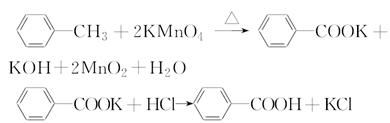
已知甲苯的熔点为-95℃,沸点为110.6℃,易挥发,密度为0.866 g·cm-3;苯甲酸的熔点为122.4℃,在25℃和95℃下溶解度分别为0.3 g和6.9 g。
【制备产品】 30.0 mL甲苯和25.0 mL 1 mol·L-1高锰酸钾溶液在80℃下反应30 min,装置如图所示:
(1)图中支管的作用是_______________________。
(2)冷凝管的作用是________;进水口为________(填“a”或“b”)。
(3)相对于用酒精灯直接加热,用沸水浴加热的优点是________;在本实验中,三颈烧瓶最合适的容积是________(填字母)。
| A.50 mL | B.100 mL | C.200 mL | D.250 mL |
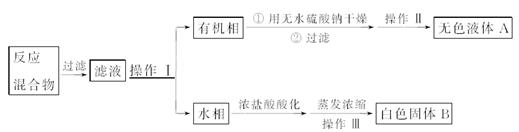
(4)操作Ⅰ的名称是________;含有杂质的产物经操作Ⅱ进一步提纯得无色液体A,则操作Ⅱ的名称是________。
(5)操作Ⅲ的名称是________。检验B中是否含有Cl-的方法如下:取少量B溶于水,在上层清液中滴加稀硝酸酸化的________溶液,若产生白色沉淀,则B中含有Cl-。
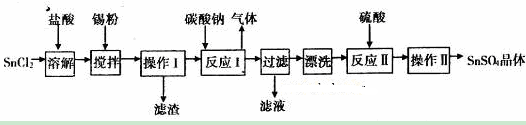
某校化学兴趣小组为了探究粗铁粒(含有少量金属铜杂质)与某浓度硝酸反应,设计了如下探究活动:
探究一
(1)将粗铁粒投入某浓度硝酸中,某同学观察该实验现象时发现,反应进行一段时间后,反应开始逐渐加快。请分析反应逐渐加快的可能原因①_____________②_____________。
(2)另称取粗铁粒10 g放入某浓度硝酸中,充分反应后得到溶液X并收集到气体Y。为了探究溶液X中铁元素的价态,甲同学设计如下实验:
有药品和仪器:0.1mol/L KSCN溶液、0.1mol/L KI溶液、0.2mol/L酸性高锰酸钾溶液、氯水等,试管和滴管。
请你设计简单实验,探究上述猜想是否正确,填写下列实验报告:
| 实验步骤 | 现象 | 结论 | 离子方程式 |
| 第一步 | 取2~3 mL溶液装于试管,向试管中加入几滴KSCN溶液。 | | |
| 第二步 | | 若溶液紫色褪去,则溶液含有Fe2+;若无明显变化,则不含Fe3+。 | |
为了探究气体Y的成分,同学乙设计了如下装置(不考虑NO2转化为N2O4)

(3)装置乙的作用: 。
(4)装置丙收集满气体后,通过气泡鼓入空气后,有红棕色气体生成,能否确定气体Y中含NO?说明理由__________ __。
(5)同学丁为了探究气体Y的组成,在标准状况下将224mL气体Y通入足量的NaOH溶液中,气体被完全吸收,所得溶液再用0.1500mol/L酸性KMnO4溶液滴定,消耗20.00mLKMnO4溶液。则气体Y中NO、NO2的体积比为 。(已知2NO2+2NaOH=NaNO3+NaNO2+H2O和NO2+NO+2NaOH=2NaNO2+H2O)
某混合金属粉末,除Mg外,还含有Al、Zn中的一种或两种,含量都在10%以上.某研究小组设计实验探究该混合金属粉末中铝、锌元素的存在.
所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3·H2O.
该小组探究过程如下:
●查阅资料:
| ①镁、铝、锌都是银白色的金属; ②锌(Zn)可以与NaOH溶液反应生成H2; ③Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3·H2O; ④Zn2+易形成络合物如[Zn(NH3)4]2+,该络合物遇强酸分解生成Zn2+、NH4+. |
(1)假设①:该混合金属粉末中除镁外还含有________元素
假设②:该混合金属粉末中除镁外还含有________元素
假设③:该混合金属粉末中除镁外还含有铝、锌元素
●实验探究:
甲同学基于假设③设计实验方案如下:
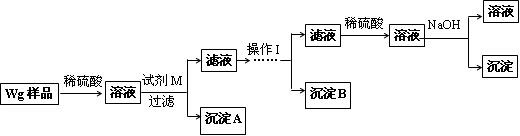
乙同学同样基于假设3设计另一实验方案如下:
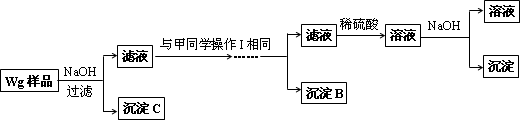
(2)试剂M是____________,沉淀B是_____________.
(2)试剂M是____________,沉淀B是_____________.
(3)丙同学认为乙同学的方案比甲同学的好,理由是_______________________.
(4)丁同学研究了甲、乙两同学的方案后,在其中一种方案的基础上用最简便方法测定了Wg样品中金属镁(Mg)的质量,他的方法是____________________________.
(5)操作Ⅰ的主要过程是:在滤液中逐滴加入_______________,直至生成的沉淀刚好溶解,再加入足量的____________________.