题目内容
【题目】(1)比较氧化性相对强弱:Cl2_______I2(填“)”>“<”或“=”);用一个离子方程式说明Cl2和I2氧化性的相对强弱_______。
(2)NH5是离子化合物,各原子最外层满足稳定结构。写出NH5的电子式__________。
(3)请用系统命名法对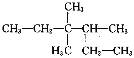 命名__________。
命名__________。
【答案】> Cl2+2Iˉ=I2+2Clˉ 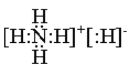 3,3,4-三甲基己烷
3,3,4-三甲基己烷
【解析】
(1)同主族元素从上到下,非金属性减弱,单质的氧化性减弱,可以使用氯气将碘离子氧化成碘单质的性质验证单质氧化性的强弱;
(2) NH5是离子化合物,各原子最外层满足稳定结构,NH5可以由铵根离子和氢负离子结合形成离子键;
(3)找到最长的碳链,含有六个碳原子,找到取代基的位置,保证取代基的序号最小。
(1) 同主族元素从上到下,非金属性减弱,非金属性Cl>I,单质的氧化性减弱,Cl2>I2,可以利用氯气和碘化钾溶液反应置换出碘单质的反应,比较出氯气和碘的氧化性的强弱,离子方程式为Cl2+2Iˉ=I2+2Clˉ;
(2)NH5是离子化合物,各原子最外层满足稳定结构,NH5可以由铵根离子和氢负离子结合形成离子键,电子式为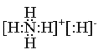 ;
;
(3)找到最长的碳链,含有六个碳原子,为己烷,取代基有三个,名称是甲基,位于3号碳有两个甲基,四号碳上有一个甲基,系统命名法为3,3,4-三甲基己烷。

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案【题目】某学生用0.10mol/L的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上步骤有错误的是(填编号)___。
(2)判断滴定终点的现象是___。
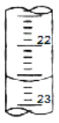
(3)如图是某次滴定时滴定管中的液面,其读数为__mL。
(4)根据下列数据:请计算待测盐酸溶液的物质的量浓度c(HCl)=___mol/L。
滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |
(5)若测定结果偏高,其原因可能是___。
A.在配制0.10mol/LNaOH标准溶液定容时,俯视容量瓶刻度线
B.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
C.滴定终点读数时,仰视滴定管的刻度
D.步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡
(6)某同学用0.10mol/LNaOH标准溶液分别滴定20.00mL0.10mol/L的HCl溶液和20.00mL0.10mol/L的CH3COOH溶液,得到如图所示的两条滴定曲线:
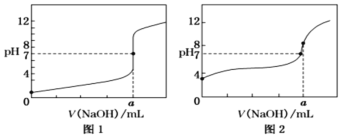
①用0.10mol/L的NaOH标准溶液滴定20.00mL0.10mol/L的CH3COOH溶液的曲线是___(填“图1”或“图2”)。
②a=___mL。
【题目】用方铅矿(主要成分为PbS,含有杂质FeS等)和软锰矿(主要成分为MnO2,还有少量Fe2O3,Al2O3等杂质) 制备PbSO4和Mn3O4的工艺流程如下:

已知:①浸取中主要反应:PbS+MnO2+4HCl=MnCl2+PbCl2+S+2H2O
②PbCl2难溶于冷水,易溶于热水;PbCl2 (s)+2Cl-(aq)![]() PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
③Mn3O4是黑色不溶于水的固体,制备原理为:6MnCl2+O2+12NH3H2O=2Mn3O4↓+12NH4Cl+6H2O
④部分金属离子开始沉淀和沉淀完全的pH如下(开始沉淀的pH按金属离子浓度为0.1mol·L1计算)。
金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ |
开始沉淀的pH | 7.6 | 2.7 | 4.0 | 7.7 |
沉淀完全的pH | 9.6 | 3.7 | 5.2 | 9.8 |
(1)“浸取”需控制温度在80℃左右,为加快酸浸速率,还可采用的方法是______。
(2)加入饱和NaCl溶液的目的是______。
(3)“浸取”过程中MnO2将Fe2+氧化的离子方程式为______。
(4)用MnCO3调节溶液pH的范围为______。
(5)“趁热抽滤”的目的是______。
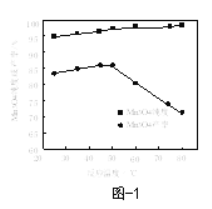
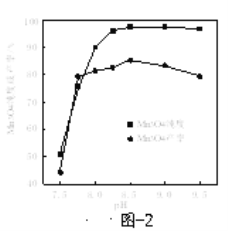
(6)已知:反应温度和溶液pH对Mn3O4的纯度和产率影响分别如图1、图2所示,请补充完整由滤液X制备Mn3O4的实验方案:______,真空干燥4小时得产品Mn3O4。(实验中须使用的试剂:氨水、空气)