题目内容
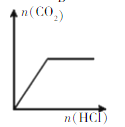
【题目】如图是部分短周期元素的常见化合价与原子序数的关系图:
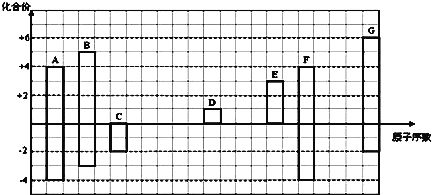
注:答题时,A—G所有元素都用其对应的元素符号表示。
(1)画出A的原子结构示意图______________;
(2)A的某氢化物分子式为A2H6,将含630mol电子的A2H6在氧气中完全燃烧生成稳定氧化物(H的稳定氧化物为液态)时放出的热量为QkJ,请写出表示1molA2H6完全燃烧的热化学方程式:_____________;
(3)用电子式表示D2G的形成过程______________;其所含化学键类型为________;
(4)C2-、D+、G2-离子半径大小顺序是___>____>____;
(5)C、G元素所形成的氢化物稳定性为___>____(填化学式),原因是:______________;
(6)某同学设计实验证明A、B、F的非金属性强弱关系, 装置如图。
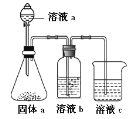
①溶液a和b分别为_________,__________;
②溶液c中发生反应的离子方程式为_____________。
【答案】![]() C2H6(g)+
C2H6(g)+ ![]() O2(g)=2CO2(g)+3H2O(l) △H=-
O2(g)=2CO2(g)+3H2O(l) △H=-![]() kJ·mol-1;
kJ·mol-1; ![]() 离子键 S2- O2- Na+ H2O H2S O的非金属性大于S(或其他合理答案) 硝酸(HNO3) 饱和NaHCO3溶液 SiO32-+CO2+H2O=H2SiO3↓+CO32-或SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-
离子键 S2- O2- Na+ H2O H2S O的非金属性大于S(或其他合理答案) 硝酸(HNO3) 饱和NaHCO3溶液 SiO32-+CO2+H2O=H2SiO3↓+CO32-或SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-
【解析】
A元素的主要化合价是+4价和-4价,而C元素没有正价,主要化合价是-2价,所以C是氧元素,则A是碳元素,B是氮元素。D的主要化合价是+1价,D是Na元素,E的主要化合价是+3价,E是铝元素。F的主要化合价是+4价和-4价,则F是硅元素。G元素的主要化合价是-2价和+6价,则G是硫元素。
(1)A是碳元素,则A的原子结构示意简图为![]() ;
;
(2)A的某氢化物分子式为A2H6,该化合物是乙烷。乙烷是18电子,则含630mol电子乙烷的物质的量是![]() =35mol。在氧气中完全燃烧生成稳定氧化物放出的热量为QkJ,又因为燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,则表示乙烷燃烧热的热化学方程式为C2H6(g)+
=35mol。在氧气中完全燃烧生成稳定氧化物放出的热量为QkJ,又因为燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,则表示乙烷燃烧热的热化学方程式为C2H6(g)+ ![]() O2(g)=2CO2(g)+3H2O(l) △H=-
O2(g)=2CO2(g)+3H2O(l) △H=-![]() kJ·mol-1,故答案为:C2H6(g)+
kJ·mol-1,故答案为:C2H6(g)+ ![]() O2(g)=2CO2(g)+3H2O(l) △H=-
O2(g)=2CO2(g)+3H2O(l) △H=-![]() kJ·mol-1;
kJ·mol-1;
(3)钠和S是活泼的金属和非金属,二者形成的化合物硫化钠是离子化合物,含有离子键,其形成过程可表示为![]() ,故答案为:
,故答案为:![]() ;离子键;
;离子键;
(4)离子的核外电子层数越多,离子半径越大。在核外电子排布相同的条件下,原子序数越大,离子半径越小,则C2-、D+、G2-离子半径大小顺序是S2->O2->Na+,故答案为:S2-;O2-;Na+;
(5)非金属性越强,氢化物的稳定性越强。O的非金属性大于S,所以水的稳定性强于H2S;故答案为:H2O;H2S;O的非金属性大于S(或其他合理答案);
(6)①非金属性越强,相应最高价氧化物对应水化物的酸性越强。又因为较强酸可以制备较弱酸,则要比较C、N、Si三种元素的非金属性强弱,溶液a为硝酸,固体a为碳酸钙,由于硝酸易挥发,生成的CO2中混有硝酸,所以在通入硅酸钠溶液之前需要利用饱和碳酸氢钠溶液除去CO2中的硝酸,即b为饱和碳酸氢钠溶液,故答案:硝酸(HNO3);饱和NaHCO3溶液;
②根据以上分析可知溶液c中发生反应的离子方程式为SiO32-+CO2+H2O=H2SiO3↓+CO32-或SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-,故答案为:SiO32-+CO2+H2O=H2SiO3↓+CO32-或SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-。

【题目】对下列各项叙述的判断及理由正确的是
选项 | 叙述 | 判断及理由 |
A | 糖类和油脂完全燃烧的产物是CO2和水 | 正确.糖类和油脂的组成元素是C、H、O |
B | 一定条件下乙醇、甲烷均能发生取代反应 | 错误.乙醇不能发生取代反应 |
C | 淀粉和纤维素是同分异构体 | 正确.淀粉和纤维素的化学式均为(C6H10O5)n |
D | 若乙烯中混有SO2气体,可通过酸性高锰酸钾溶液除去 | 正确.酸性条件下SO2可被高锰酸钾氧化 |
A.AB.BC.CD.D