��Ŀ����
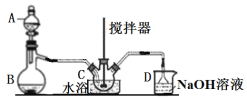
����Ŀ���÷�Ǧ��(��Ҫ�ɷ�ΪPbS����������FeS��)�����̿�(��Ҫ�ɷ�ΪMnO2����������Fe2O3��Al2O3������) �Ʊ�PbSO4��Mn3O4�Ĺ����������£�

��֪���ٽ�ȡ����Ҫ��Ӧ��PbS��MnO2��4HCl��MnCl2��PbCl2��S��2H2O
��PbCl2��������ˮ����������ˮ��PbCl2 (s)+2Cl-(aq)![]() PbCl42-(aq) ��H��0
PbCl42-(aq) ��H��0
��Mn3O4�Ǻ�ɫ������ˮ�Ĺ��壬�Ʊ�ԭ��Ϊ��6MnCl2��O2��12NH3H2O��2Mn3O4����12NH4Cl��6H2O
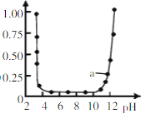
�ܲ��ֽ������ӿ�ʼ�����ͳ�����ȫ��pH����(��ʼ������pH����������Ũ��Ϊ0.1mol��L1����)��
�������� | Fe2+ | Fe3+ | Al3+ | Mn2+ |
��ʼ������pH | 7.6 | 2.7 | 4.0 | 7.7 |
������ȫ��pH | 9.6 | 3.7 | 5.2 | 9.8 |
��1������ȡ��������¶���80�����ң�Ϊ�ӿ�������ʣ����ɲ��õķ�����______��
��2�����뱥��NaCl��Һ��Ŀ����______��
��3������ȡ��������MnO2��Fe2+���������ӷ���ʽΪ______��
��4����MnCO3������ҺpH�ķ�ΧΪ______��
��5�������ȳ��ˡ���Ŀ����______��
��6����֪����Ӧ�¶Ⱥ���ҺpH��Mn3O4�Ĵ��ȺͲ���Ӱ��ֱ���ͼ1��ͼ2��ʾ���벹����������ҺX�Ʊ�Mn3O4��ʵ�鷽����______����ո���4Сʱ�ò�ƷMn3O4����ʵ������ʹ�õ��Լ�����ˮ��������
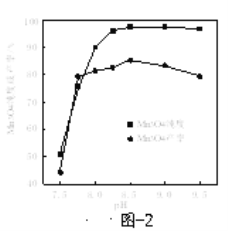
���𰸡������ʯ�������ʵ���������Ũ�� ����PbCl2���ܽ�� 2Fe2+��MnO2��4H+��Mn2+��2Fe3+��2H2O 5.2��pH��7.7 PbCl2�����ᾧ���������ȳ���������Ǧ�Ļ������벻�������ʷ��� ����ҺXˮԡ���Ȳ�����50�棬�ð�ˮ������ҺpH��ά����8.5���ң��ڲ��Ͻ����£���ͨ�����Ӱ�ˮ��ֱ���д�����ɫ��������ʱ�����ã����ϲ���Һ�м����μӰ�ˮ�����г������ɣ����ˣ�ϴ�ӳ���2~3��ֱ��ϴ��Һ���鲻��Cl
��������
���Ƚ���Ǧ������̿������ͱ����Ȼ�����Һ��ȡ������ʽ����Ѿ����������������˵õ�������IΪ�������������������ʣ�����������̼���̵���pH�����ȳ��˿��Ա����Ȼ�Ǧ�ܽ���ˮ�У������������ʱ����ˣ�����ȴ���˼��ɵõ��������Ȼ�Ǧ����ҺX�е��Ȼ�����ͨ����ɸ����ķ���ʽ�Ʊ����������̣����Ȼ�Ǧ����������Һ��Ӧ����ת��Ϊ�����ܵ�����Ǧ�������ݴ����������ɡ�
��1��Ϊ�ӿ��ܽ⣬���ǿ���ͨ�����衢�����ʯ������Ӵ�������ʵ���������Ũ�ȷ�����
��2�������Ȼ�����Һ���д�����![]() �����Դٽ�����и����ķ�Ӧ�ڵ�������У������Ȼ�Ǧ���ܽ�ȣ�
�����Դٽ�����и����ķ�Ӧ�ڵ�������У������Ȼ�Ǧ���ܽ�ȣ�
��3������������+4�۵�����ǿ�����ԣ�![]() ���л�ԭ�ԣ����߷���������ԭ��Ӧ��
���л�ԭ�ԣ����߷���������ԭ��Ӧ��![]() ��
��
��4������pH��Ŀ���ǽ���Һ�г�������������������ӳ�ȥ��������Ŀ�����ı�����Է��ֵ�![]() ʱ
ʱ![]() ��
��![]() �Ѿ�������ȫ����
�Ѿ�������ȫ����![]() ʱ�̽���ʼ��������ɲ������ʧ��������pH��ΧΪ
ʱ�̽���ʼ��������ɲ������ʧ��������pH��ΧΪ![]() ��
��
��5����Ŀ��֪�����Ȼ�Ǧ��������ˮ����������ˮ����˳��ȹ��˿ɽ��Ȼ�Ǧ��������Һ�У��������������������ォ�����˳�ȥ��
��6��������ͼ���ѿ�����50���pH8.5��������ѵķ�Ӧ������������ǽ���ҺXˮԡ���Ȳ�����50�棬�ð�ˮ������ҺpH��ά����8.5���ң��ڲ��Ͻ����£���ͨ�����Ӱ�ˮ��ֱ���д�����ɫ��������ʱ�����ã����ϲ���Һ�м����μӰ�ˮ�����г������ɣ����ˣ�ϴ�ӳ���2~3��ֱ��ϴ��Һ���鲻��![]() ���ɡ�
���ɡ�

 ��Կ���Ծ�ϵ�д�
��Կ���Ծ�ϵ�д�����Ŀ����+6�۸��ķ�ˮ����ǿ���Ի�����Ⱦ���أ���ҵ�ϳ����û�ѧԭ����+6�۸�ת��Ϊ������Cr(OH)3��ȥ��
��SO2��ԭ��������������SO2����������ˮ���乤����������ͼ��ʾ��
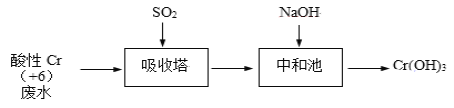
��֪��Cr2O72- + H2O ![]() 2CrO42- + 2H+���������� Cr2O72-��SO2��Ӧ���£�Cr2O72��(aq)+3SO2(g)+2H+(aq)�T2Cr3+(aq)+3SO42��(aq)+H2O(l) ��H = -1145 kJ/mol��
2CrO42- + 2H+���������� Cr2O72-��SO2��Ӧ���£�Cr2O72��(aq)+3SO2(g)+2H+(aq)�T2Cr3+(aq)+3SO42��(aq)+H2O(l) ��H = -1145 kJ/mol��
��1�������������䣬�о���������pH�Է�Ӧ��Ӱ�졣
pH | 2 | 4 | 6 |
Cr��+6�����ȥ���� | 99.99%���ŷű� | 99.95%���ŷű� | 99.5%δ���ŷű� |
ʱ�� | 30 min | 35 min | 45 min |
�����������ݻ�õ�������_________��
��ʵ�ʹ�ҵ��������pH = ____���ҡ�
������˵������������_____��
a.�����Ժ�����ˮ��һ������CrO42-��pHԽ���京��Խ��
b.�����������䣬����ѹǿ���������з�Ӧ��K���������ڳ�ȥCr��+6��
c.�����Ͽ���SO32-��Fe2+��Ҳ�������ڳ�ȥCr��+6��
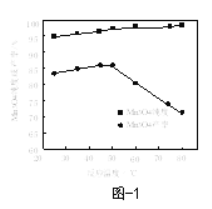
��2�������������䣬�о��¶ȶ�Cr��+6��ȥ���ʵ�Ӱ�죨��ͼ��ʾ����
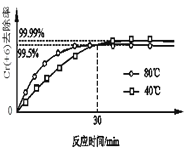
��֪��30minǰ��ͬʱ���ڣ�80���Cr��+6��ȥ���ʱ�40��ߣ�����Ϊ30minǰ��Ӧ������У��¶ȸ߷�Ӧ���ʿ췴Ӧ���ת���������Խ���30min��80���Cr��+6��ȥ���ʵ͵�ԭ��________��
��ⷨ������
��ҵ�ϴ�����Cr2O72-���ӵ����Է�ˮ����������ҵ��ˮ�м���������ʳ�Σ�����FeΪ�缫���е�⣬��Cr2O72�����ӻ�ԭΪ���������۸����ӣ��ٵ�pHʹ���۸����ӱ�Ϊ���������������ȥ��
��1������ʳ�ε�Ŀ���� _______��
��2�����ʱ������ӦʽΪ _________��