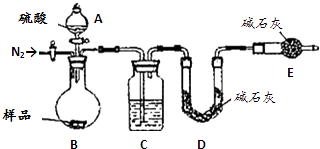
��Ŀ����
����Ŀ��A��B��C��D�������ʾ�Ϊ����������ɵĿ����Ի����������������ʵ����ӣ����Ӳ����ظ���ϣ��У�
������ | Na+��Al3+��Ba2+��NH4+ |
������ | Cl����OH����CO32����SO42�� |
�ֱ�ȡ�������ʽ���ʵ�飬ʵ��������
��B��Һ�ֱ���C��D��ϣ����а�ɫ�������ɣ�
�ڽ�A��Һ��ε���C��Һ�У��г������ɣ������μ�A��Һʱ����������ֱ����ȫ��ʧ��
��A��D���ֹ����ϼ������������ɣ���������ʹʪ��ĺ�ɫʯ����Һ������
����ʯī�缫���B��Һ���������ϲ���һ���д̼�����ζ�����壮
��1��A�����������ӵĵ���ʽ�� �� B�������������� ��
��2��C�Ļ�ѧʽ�� �� D�Ļ�ѧʽ�� ��
��3��д�����г����ܽ�����ӷ���ʽ ��
���𰸡�
��1��![]() ��Ba2+
��Ba2+
��2��Al2��SO4��3����NH4��2CO3
��3��Al��OH��3+OH��=AlO2��+2H2O
���������⣺�ڽ�A��Һ��ε���C��Һ�У��г������ɣ������μ�A��Һʱ����������ֱ����ȫ��ʧ��˵��AΪǿ����Һ����AΪNaOH������������C�к���Al3+ �� ��C�к��е�������ΪCl����SO42������A��D���ֹ��������������ɣ���������ʹʪ��ĺ�ɫʯ����Һ����������Ϊ����������AΪǿ���D�к���NH4+������ʯī�缫���B��Һ���������ϲ���һ���д̼�����ζ�����壬���������ܹ������̼�����ζ�������ΪCl�� �� ��B�к���Cl���� �ɢڢ��з�����֪��B�к��е�������ΪNa+��Ba2+ �� �ɢ�B��Һ�ֱ���C��D��ϣ����а�ɫ�������ɣ�B�к���Cl�� �� �����������в����������������ɳ��������ӣ�����ֻ����B�е����������ɳ���������BΪBaCl2 �� ��AΪNaOH��CΪAl2��SO4��3 �� DΪ��NH4��2CO3 �� ��1��AΪNaOH�������������ӵĵ���ʽ�� ![]() ��BΪBaCl2 �� ������������ΪBa2+ �� ���Դ��ǣ�
��BΪBaCl2 �� ������������ΪBa2+ �� ���Դ��ǣ� ![]() ��Ba2+����2��C�Ļ�ѧʽΪAl2��SO4��3 �� D�Ļ�ѧʽΪ��NH4��2CO3 �� ���Դ��ǣ�Al2��SO4��3����NH4��2CO3����3���������ɵij���Ϊ���������������ܽ�����ӷ���ʽΪ��Al��OH��3+OH��=AlO2��+2H2O�����Դ��ǣ�Al��OH��3+OH��=AlO2��+2H2O��
��Ba2+����2��C�Ļ�ѧʽΪAl2��SO4��3 �� D�Ļ�ѧʽΪ��NH4��2CO3 �� ���Դ��ǣ�Al2��SO4��3����NH4��2CO3����3���������ɵij���Ϊ���������������ܽ�����ӷ���ʽΪ��Al��OH��3+OH��=AlO2��+2H2O�����Դ��ǣ�Al��OH��3+OH��=AlO2��+2H2O��