题目内容
【题目】有四种化合物W,X,Y,Z,它们都是由短周期元素A,B,C,D,E中的两种元素组成的.已知: (a)A,B,C,D,E五种元素的原子序数依次增大,且A,D同主族,C,E同主族,B、C同周期.
(b)W由B,C组成,分子中原子个数比为B:C=1:2,固体易升华.
(c)X由A,C组成,分子中原子个数比为A:C=1:1.
(d)Y由C,D形成的离子化合物,且Y中相应元素的微粒之比为:C:D=1:1.
(e)Z是由D,E形成的离子化合物,其中阳离子比阴离子少一个电子层,阴、阳离子数之比为1:2.
试回答下列各小题:
(1)各元素符号:ABCDE
(2)W的电子式: .
(3)X的结构式: .
(4)Y的电子式: .
(5)Z的化学式: .
(6)写出Y与水反应的化学方程式: .
【答案】
(1)H;C;O;Na;S
(2)![]()
(3)H﹣O﹣O﹣H
(4)![]()
(5)Na2S
(6)2Na2O2+2H2O═4NaOH+O2↑
【解析】解:四种化合物W,X,Y,Z.它们都是由短周期元素A,B,C,D,E中两种元素组成,A,B,C,D,E五种元素的原子序数依次增大,且A、D同主族;C,E同主族,只能是A处于第一周期,C处于第二周期、;D,E处于第三周期,则A为H元素,D为Na;Z是由D,E形成的离子化合物,E形成阴离子,其中阳离子比阴离子少一个电子层,阴、阳离子数之比为1﹕2,则E形成的阴离子带2个单位负电荷,所以E是S元素,则Z是Na2S;C和E同主族,所以C是O元素;X由A和C组成,分子中原子个数比A﹕C=1﹕1,则X是H2O2;Y是由C、D形成的离子化合物,且Y中相应元素的微粒之比为C:D=1:1,则Y是Na2O2;B与C同周期,W由B C组成,分子中原子个数比为B:C=1:2,固体易升华,则B为碳元素,W为CO2 . (1)通过以上分析知:A,B,C,D,E分别是:H,C,O,Na、S 元素,故答案为:H;C;O;Na;S;(2)W为CO2 , 电子式为: ![]() ,故答案为:
,故答案为: ![]() ;(3)X是H2O2 , 结构式为:H﹣O﹣O﹣H,故答案为:H﹣O﹣O﹣H;(4)Y为Na2O2 , 电子式是:
;(3)X是H2O2 , 结构式为:H﹣O﹣O﹣H,故答案为:H﹣O﹣O﹣H;(4)Y为Na2O2 , 电子式是: ![]() ,故答案为:
,故答案为: ![]() ;(5)Z的化学式:Na2S,故答案为:Na2S;(6)Y与水反应的化学方程式:2Na2O2+2H2O═4NaOH+O2↑,故答案为:2Na2O2+2H2O═4NaOH+O2↑. 四种化合物W,X,Y,Z.它们都是由短周期元素A,B,C,D,E中两种元素组成,A,B,C,D,E五种元素的原子序数依次增大,且A,D同主族,C,E同主族,只能是A处于第一周期,C处于第二周期;D,E处于第三周期,则A为H元素,D为Na;Z是由D、E形成的离子化合物,E形成阴离子,其中阳离子比阴离子少一个电子层,阴、阳离子数之比为1﹕2,则E形成的阴离子带2个单位负电荷,所以E是S元素,则Z是Na2S;C和E同主族,所以C是O元素;X由A、C组成,分子中原子个数比A﹕C=1﹕1,则X是H2O2;Y是由C,D形成的离子化合物,且Y中相应元素的微粒之比为C:D=1:1,则Y是Na2O2;B,C同周期,W由B,C组成,分子中原子个数比为B:C=1:2,固体易升华,则B为碳元素,W为CO2 , 据此解答.
;(5)Z的化学式:Na2S,故答案为:Na2S;(6)Y与水反应的化学方程式:2Na2O2+2H2O═4NaOH+O2↑,故答案为:2Na2O2+2H2O═4NaOH+O2↑. 四种化合物W,X,Y,Z.它们都是由短周期元素A,B,C,D,E中两种元素组成,A,B,C,D,E五种元素的原子序数依次增大,且A,D同主族,C,E同主族,只能是A处于第一周期,C处于第二周期;D,E处于第三周期,则A为H元素,D为Na;Z是由D、E形成的离子化合物,E形成阴离子,其中阳离子比阴离子少一个电子层,阴、阳离子数之比为1﹕2,则E形成的阴离子带2个单位负电荷,所以E是S元素,则Z是Na2S;C和E同主族,所以C是O元素;X由A、C组成,分子中原子个数比A﹕C=1﹕1,则X是H2O2;Y是由C,D形成的离子化合物,且Y中相应元素的微粒之比为C:D=1:1,则Y是Na2O2;B,C同周期,W由B,C组成,分子中原子个数比为B:C=1:2,固体易升华,则B为碳元素,W为CO2 , 据此解答.

【题目】苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)C8H8(g)+H2(g)△H>0 Ⅰ.某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2[来源:] | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(1)当反应进行到20min时,该段时间内H2的平均反应速率是 .
(2)该温度下,该反应的化学平衡常数是 .
化学键 | C﹣H | C﹣C | C=C | H﹣H |
键能/kJmol1 | 412.5 | 348 | 612 | 436 |
(3)已知: 计算上述反应的△H=kJmol﹣1 . 若保持其他条件不变,用0.40mol H2(g)和0.40mol C8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是 . 此时,该反应是否达到了平衡状态?(填“是”或“否”).
Ⅱ.工业上以高温水蒸气作为反应体系的稀释剂(不参与反应),C8H10(g)的平衡转化率与水蒸气的用量、体系的温度、压强的关系如图Ⅰ、图Ⅱ所示.
(4)由图Ⅰ可知,T1T2(填“大于”、“小于”或“等于”).
(5)由图Ⅱ可知,当其他条件不变时,水蒸气的用量越大,C8H10的平衡转化率将(填“越大”、“越小”或“不变”),原因是 .
【题目】研究性学习小组的同学们用如图所示装置进行铝热反应的实验,请回答: 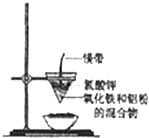
(1)氧化铁与铝反应的化学方程式是 ,
(2)镁带的作用是;氯酸钾的作用是 .
(3)同学们在实验过程中观察到纸漏斗的下部被烧穿,有熔融物落入沙中.他们为探究此熔融物的成分,查阅(化学手册)得知有关物质的熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2054 | 1535 | 1462 |
沸点/℃ | 2467 | 2980 | 2750 | ﹣ |
同学们分析数据后推测该熔融物是一种合金,其中的金属是 , 溶解该合金可选用下列试剂中的(填序号).
A.FeSO4溶液 B.稀硫酸 C.稀硝酸 D.NaOH溶液.