题目内容
【题目】LED产品的使用为城市增添色彩。下图是氢氧燃料电池驱动LED发光的一种装置示意图。下列有关叙述正确的是( )
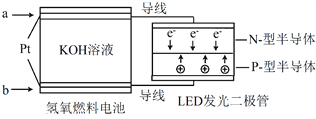
A. 电路中的电子从负极经外电路到正极,再经过KOH溶液回到负极,形成闭合回路
B. a处通入氢气, b处通氧气,该装置将化学能最终转化为电能
C. 电池放电后, OH-的物质的量浓度减小
D. 通入O2的电极发生反应:O2 + 4e- = 2O2-
【答案】C
【解析】A. 电路中的电子从负极经外电路到正极,但是电子不经过KOH溶液,A不正确;B. 由外电路中电子的运动方向可知,a是负极、b是正极,故a处通入氢气、 b处通氧气,该装置将化学能最终转化为光能,B不正确;C. 电池放电后,电池反应产物是水,故 OH-的物质的量浓度减小,C正确;D. 通入O2的电极发生反应为O2 + 2H2O+4e- = 4OH-,D不正确。本题选C。

 阅读快车系列答案
阅读快车系列答案【题目】已知β锂辉矿(主要成分为LiAlSi2O6 , 还含有FeO、MgO、CaO等杂质),下面是以锂辉矿为原料来制取金属锂的一种工艺流程.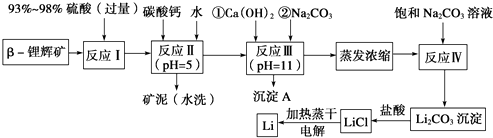
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.7 | 9.6 |
完全沉淀pH | 3.7 | 4.7 | 11 |
②Li2CO3在不同温度下的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
请回答下列问题:
(1)为了提高β锂辉矿浸出率可采取措施有 .
(2)反应Ⅰ发生主反应:LiAlSi2O6+H2SO4(浓Li2SO4+++H2O,根据题意配平上述方程式.
(3)反应Ⅱ加入碳酸钙的作用是 .
(4)反应Ⅲ中生成沉淀A成分: . (填化学式)
(5)蒸发浓缩过程中主要发生离子反应方程式: .
(6)洗涤所得Li2CO3沉淀要使用(选填“热水”或“冷水”),你选择的理由是 .
(7)电解熔融氯化锂生产锂时,阳极产生的Cl2中会混有少量O2 , 用电极反应式说明原因 .
【题目】A,B,C,D四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:
阳离子 | Na+、Al3+、Ba2+、NH4+ |
阴离子 | Cl﹣、OH﹣、CO32﹣、SO42﹣ |
分别取四种物质进行实验,实验结果如下
①B溶液分别与C,D混合,均有白色沉淀生成;
②将A溶液逐滴滴入C溶液中,有沉淀生成,继续滴加A溶液时,沉淀减少直至完全消失;
③A与D两种固体混合加热有气体生成,该气体能使湿润的红色石蕊试液变蓝;
④用石墨电极电解B溶液,在阳极上产生一种有刺激性气味的气体.
(1)A所含的阴离子的电子式是 , B所含的阳离子是 .
(2)C的化学式是 , D的化学式是 .
(3)写出②中沉淀溶解的离子方程式 .