��Ŀ����
����Ŀ�������ǹ�ҵ�������ճ������е���Ҫ���ʣ�ij��ȤС��Ϊ�ⶨij��ҵ����������̼���������ʣ���̼���Ƶ������������������������ʵ�鷽������̽��������գ�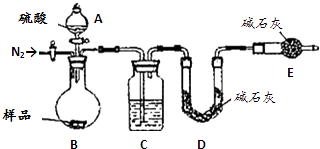
����һ��������Ʒ ![]() �ⶨʣ���������
�ⶨʣ���������
��1���ֱ��ȡ���������ʹ�����Ʒ����������������Ʒ���������г�ּ��ȣ������з�����Ӧ�Ļ�ѧ����ʽΪ�� ��
��2�����������ڸ���������ȴ�������ʵ��ʱ��Ҫ�ظ������ȡ���ȴ��������������Σ���Ŀ���ǣ� �� ����������ȡmg��Ʒ���250mL��Һ������ȡ25mL��Һ���÷�̪��ָʾ����0.1molL��1HCl��Һ�ζ����յ㣬����0.1molL��1HCl��ҺV1mL�������ü�����ָʾ���ζ����յ㣬����0.1molL��1HCl��ҺV2mL�������Ʒ��̼���Ƶ���������Ϊ�� ��
��������������Ʒ��Һ ![]() �ⶨ��������
�ⶨ��������
��3����ȡm1g��Ʒ������С�ձ��У���ˮ�ܽ⣮��С�ձ��еμ������Ȼ�����Һ������Ӧ�������˺����һ�������ǣ� �� ��������������Ϊm2g��
��4�����������������Һ�����Ȼ�����Һ����������������������ȷ������£������Ʒ�е�̼����������������ʵ�����ƫ�ߡ�����ƫ�͡����䡱���������ģ�������Ʒ ![]() �ⶨ���ɶ�����̼������
�ⶨ���ɶ�����̼������
��5����ʵ���������ͼװ�ã�C��ʢ�ŵ������� ��
��6����Ӧǰ��Ҫͨ��N2 �� ��Ӧ��ͨ��N2��Ŀ���� ��
���𰸡�
��1��2NaHCO3 ![]() Na2CO3+CO2��+H2O
Na2CO3+CO2��+H2O
��2�����������أ��Ա�֤NaHCO3ȫ���ֽ⣻![]() ��100%
��100%
��3��ϴ�ӳ���
��4������
��5��Ũ����
��6���ž�װ���ڵĿ����������ɵĶ�����̼���������ų�����Dװ���м�ʯ������
���������⣺����һ����1�������з�����Ӧ�Ļ�ѧ����ʽΪ��2NaHCO3 ![]() Na2CO3+CO2��+H2O�����Դ��ǣ�2NaHCO3
Na2CO3+CO2��+H2O�����Դ��ǣ�2NaHCO3 ![]() Na2CO3+CO2��+H2O����֤NaHCO3ȫ���ֽ⣮��2���÷������ݼ��Ⱥ��������������⣬Ҫ���������أ��Ա�֤NaHCO3ȫ���ֽ⣬���Դ��ǣ����������أ��Ա�֤NaHCO3ȫ���ֽ⣻ ������������ʵ��ԭ�����÷�̪��ָʾ��ʱ��������ӦΪ��Na2CO3+HCl=NaHCO3+NaCl����0.1molL��1 HCl��Һ�ζ����յ㣬����0.1molL��1 HCl��ҺV1 mL��Ӧ����V1������̼���Ƶ������������ü�����ָʾ���ζ����յ㣬������Ӧ����NaHCO3+HCl=H2O+CO2��+NaCl������0.1molL��1HCl��ҺV2mL�����ݣ�V2��V1������NaHCO3����������Na2CO3����������Ϊ��
Na2CO3+CO2��+H2O����֤NaHCO3ȫ���ֽ⣮��2���÷������ݼ��Ⱥ��������������⣬Ҫ���������أ��Ա�֤NaHCO3ȫ���ֽ⣬���Դ��ǣ����������أ��Ա�֤NaHCO3ȫ���ֽ⣻ ������������ʵ��ԭ�����÷�̪��ָʾ��ʱ��������ӦΪ��Na2CO3+HCl=NaHCO3+NaCl����0.1molL��1 HCl��Һ�ζ����յ㣬����0.1molL��1 HCl��ҺV1 mL��Ӧ����V1������̼���Ƶ������������ü�����ָʾ���ζ����յ㣬������Ӧ����NaHCO3+HCl=H2O+CO2��+NaCl������0.1molL��1HCl��ҺV2mL�����ݣ�V2��V1������NaHCO3����������Na2CO3����������Ϊ�� ![]() =
= ![]() ��100%�����Դ��ǣ�
��100%�����Դ��ǣ� ![]() ��100%��
��100%��
����������3��̼��Ƴ����ḽ���Ȼ��ơ��Ȼ��ƣ����˺���������ˮϴ�ӳ��������Դ��ǣ�ϴ�ӳ�������4����һ������Ʒ�м�������Ca��OH��2��Һ����ʱ�ֱ������·�ӦNa2CO3+Ca��OH��2=CaCO3��+2NaOH��
NaHCO3+Ca��OH��2=CaCO3��+NaOH+H2O��������CaCO3������������Ʒ������������CaCO3�������������Լ���̼�����������Ϳɵó������������������������������Һ�����Ȼ�����Һ����������������������ȷ������£������Ʒ�е�̼���������������䣻���Դ��ǣ����䣻
�����ģ���5��Cװ�ø��������̼������C��ʢ�ŵ�������Ũ���ᣬ���Դ��ǣ�Ũ�����6���÷����ؼ���Ҫ��ò�����CO2��������ʵ��ǰ�����ں��п����������к��ж�����̼����Ӱ�����ɵĶ�����̼��������Ӧ��װ���������ں��ж�����̼�����ܱ�C�м�ʯ����ȫ���գ����²ⶨ����нϴ������Է�Ӧǰ��Ҫͨ��N2 �� ��Ӧ��ͨ��N2��Ŀ���ǣ��ž�װ���ڵĿ����������ɵĶ�����̼���������ų�����Dװ���м�ʯ�����գ�
���Դ��ǣ��ž�װ���ڵĿ����������ɵĶ�����̼���������ų�����Dװ���м�ʯ�����գ�

 ����ѧ��Ӯ�����ϵ�д�
����ѧ��Ӯ�����ϵ�д� ѧ���쳵�����ּ��������ҵ�½����������ϵ�д�
ѧ���쳵�����ּ��������ҵ�½����������ϵ�д�����Ŀ���о���ѧϰС���ͬѧ������ͼ��ʾװ�ý������ȷ�Ӧ��ʵ�飬��ش� 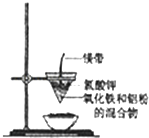
��1��������������Ӧ�Ļ�ѧ����ʽ�� ��
��2��þ����������������ص������� ��
��3��ͬѧ����ʵ������й۲쵽ֽ©�����²����մ���������������ɳ�У�����Ϊ̽����������ijɷ֣����ģ���ѧ�ֲᣩ��֪�й����ʵ��۵㡢�е��������£�
���� | Al | Al2O3 | Fe | Fe2O3 |
�۵�/�� | 660 | 2054 | 1535 | 1462 |
�е�/�� | 2467 | 2980 | 2750 | �� |
ͬѧ�Ƿ������ݺ��Ʋ����������һ�ֺϽ����еĽ����� �� �ܽ�úϽ��ѡ�������Լ��е�������ţ���
A��FeSO4��Һ B��ϡ���� C��ϡ���� D��NaOH��Һ��
����Ŀ��A��B��C��D�������ʾ�Ϊ����������ɵĿ����Ի����������������ʵ����ӣ����Ӳ����ظ���ϣ��У�
������ | Na+��Al3+��Ba2+��NH4+ |
������ | Cl����OH����CO32����SO42�� |
�ֱ�ȡ�������ʽ���ʵ�飬ʵ��������
��B��Һ�ֱ���C��D��ϣ����а�ɫ�������ɣ�
�ڽ�A��Һ��ε���C��Һ�У��г������ɣ������μ�A��Һʱ����������ֱ����ȫ��ʧ��
��A��D���ֹ����ϼ������������ɣ���������ʹʪ��ĺ�ɫʯ����Һ������
����ʯī�缫���B��Һ���������ϲ���һ���д̼�����ζ�����壮
��1��A�����������ӵĵ���ʽ�� �� B�������������� ��
��2��C�Ļ�ѧʽ�� �� D�Ļ�ѧʽ�� ��
��3��д�����г����ܽ�����ӷ���ʽ ��