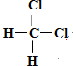题目内容
17.下列有关物质结构的表述正确的是( )| A. | H2O2的电子式: | B. | CO2的比例模型: | ||
| C. | 14C的原子结构示意图: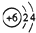 | D. | CCl4的结构式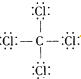 |
分析 A.双氧水属于共价化合物,分子中不存在阴阳离子;
B.二氧化碳分子中,碳原子的原子半径大于氧原子,则碳原子的相对体积应该大于氧原子;
C.14C的质子数=核电荷数=核外电子总数=6;
D.用短线代替所有共用电子对即为结构式,结构式中不需要标出孤对电子.
解答 解:A.双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水正确的电子式为: ,故A错误;
,故A错误;
B.二氧化碳的分子式为CO2,由模型可知小球为碳原子,2个大球为氧原子,氧原子半径大,实际碳原子半径大于氧原子半径,其正确的比例模型为: ,故B错误;
,故B错误;
C.14C的核电荷数、核外电子总数为6,其原子结构示意图为: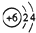 ,故C正确;
,故C正确;
D.四氯化碳的电子式为 ,用短线代替所有共用电子对即为结构式,四氯化碳的结构式为:
,用短线代替所有共用电子对即为结构式,四氯化碳的结构式为: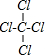 ,故D错误;
,故D错误;
故选C.
点评 本题考查了常见化学用语的表示方法判断,题目难度中等,注意掌握结构式、原子结构示意图、电子式、比例模型等化学用语的概念及书写原则,明确球棍模型与比例模型、电子式与结构式、结构简式的区别,试题侧重考查学生规范答题的能力.

练习册系列答案
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
7.下列有关检验与鉴别说法正确的是( )
| A. | 用新制氢氧化铜悬浊液能鉴别葡萄糖、甘油、乙醛、乙酸 | |
| B. | 用酸性高锰酸钾即可检验CH2=CHCHO中的碳碳双键 | |
| C. | 为检验氯乙烷中的氯元素,在水解液中滴加稀硫酸酸化,再滴入AgNO3溶液,产生白色沉淀 | |
| D. | 用溴水即可鉴别溴苯、苯、己烯与苯酚 |
8.已知C3N4晶体具有比金刚石还大的硬度,且构成该晶体的微粒间只以单键结合.下列关于C3N4晶体说法错误的是( )
| A. | 该晶体属于原子晶体,其化学键比金刚石更牢固 | |
| B. | 该晶体中每个碳原子连接4个氮原子、每个氮原子连接3个碳原子 | |
| C. | 该晶体中碳原子和氮原子的最外层都满足8电子结构 | |
| D. | 该晶体与金刚石相似,原子间都是非极性键 |
5.相同质量的锌与酸反应制备H2,欲使反应速率最大,下列条件下的最佳组合是( )
①纯锌片
②粗锌粒
③0.1mol•L-1硫酸
④98%的浓硫酸
⑤加热
⑥用冰水冷却.
①纯锌片
②粗锌粒
③0.1mol•L-1硫酸
④98%的浓硫酸
⑤加热
⑥用冰水冷却.
| A. | ①④⑤ | B. | ②③⑤ | C. | ①③⑥ | D. | ②④⑤ |
2.下列用离子方程式解释正确的是( )
| A. | 用氢氟酸在玻璃上镌刻图案:4I++SiO2═H2O+Si4+ | |
| B. | 向Cu2+、Fe3+混合液中加入CuO除去Fe3+;3H2O+3CuO+2Fe3+═2Fe(OH)3+3Cu2+ | |
| C. | 亚硫酸氢钠溶液显酸性:HSO3-═H++SO32- | |
| D. | 用盐酸与碳酸钠反应证明氯的非金属性强与炭:2H++CO32-═CO2↑+H2O |
9.实验室用浓盐酸与浓硫酸混合快速制取HCl.下列解释正确的是( )
| A. | 浓硫酸是高沸点的酸,通过它与浓盐酸反应制取低沸点的酸 | |
| B. | 通过改变温度和浓度等条件,利用平衡移动原理制取HCl | |
| C. | 两种强酸混合,溶解度会相互影响,低溶解度的物质析出 | |
| D. | 浓硫酸的浓度(98%)远大于浓盐酸的浓度(37%),高浓度的酸制取低浓度的酸 |
6.有关下列两种溶液的说法中,不正确的是( )
①0.2mo1•L-1 CH3COONa溶液 ②0.1mo1•L-1H2SO4溶液.
①0.2mo1•L-1 CH3COONa溶液 ②0.1mo1•L-1H2SO4溶液.
| A. | 相同温度下,溶液中水的电离程度:①>② | |
| B. | 向①加水后所得溶液c(CH3COO-)/c(CH3COOH)的比值变大 | |
| C. | 等体积混合溶液①和溶液②,所得溶液中2c(SO42-)=c(Na+) | |
| D. | 25℃时,向溶液②中滴加溶液①至pH=7,溶液中c(Na+)>c(CH3COO-)+c(SO42-) |
 E.
E. 和
和