��Ŀ����
����Ŀ��
���������ķ�չ���̣�Ҳ�ǻ�ѧ���ʵ���ʶ�ͷ��ֵ����̣���������������̼����ù�ء�����ء��Ҵ������ȡ����ӡ��ı����������硣
��1����ԭ���ڻ�̬ʱ����Χ�����Ų�ʽΪ____________��
��2��CO2�ĵ���ʽΪ____________��1 mol CO2�����к��ЦҼ������ʵ���Ϊ____________��
��3��6-������ù����Ľṹ��ͼ��ʾ��
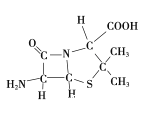
������C��N��Oԭ�Ӱ뾶�Ĵ�С��ϵΪ____________���縺�ԵĴ�С��ϵΪ____________��
�����в���sp3�ӻ���ԭ����C��____________��
��4���������NO3-�Ŀռ乹��Ϊ____________��д����NO3-��Ϊ�ȵ������һ����ǰ������Ԫ��ԭ�ӹ��ɵķǼ��Է��ӻ�ѧʽ____________��
��5���Ҵ�����Է���������������С������е��������ߣ���ԭ����____________��
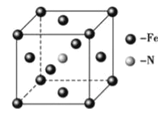
��6�����Ͱ�����640��ɷ����û���Ӧ������֮һ�ľ����ṹ��ͼ��ʾ�������������Feԭ�Ӽ�ľ���Ϊa cm����þ�����ܶȼ���ʽΪ____________g/cm3����NA��ʾ�����ӵ���������
���𰸡� 3d64s2 ![]() 2mol C>N>O C<N<O ��S��N��O ƽ�������� BF3 �Ҵ����Ӽ�������
2mol C>N>O C<N<O ��S��N��O ƽ�������� BF3 �Ҵ����Ӽ������� ![]()
![]() ��
��![]()
![]()
����������1��Fe 26��Ԫ�� ��VIII�壬��ԭ���ڻ�̬ʱ����Χ�����Ų�ʽΪ3d64s2 ����2����Ԫ�����ڱ��У�C��O��Ҫ��8�����Ӳ����ȶ�������C��O���ǹ������ӣ�ԭ��C���ֻ��4�����ӣ�����Ҫ4�����Ӳ����ȶ�����Oԭ�������6�����ӣ�������Ҫ2�����ӱ����ȶ�������C��O���γ�˫����ʹCO2�����ȶ���������̼��C=O˫����1���Ҽ���1���м�������ʽΪ![]() ��1 mol CO2�����к��ЦҼ������ʵ���Ϊ 2mol����3����ͬ����Ԫ��ԭ��ԭ������Խ��ԭ�Ӱ뾶ԼС����Ϊԭ������Խ��ԭ�Ӻ�����Խ�Ե��ӵ�����Խ��ԭ�ӵİ뾶��ԽС��C��N��Oԭ�Ӱ뾶�Ĵ�С��ϵΪC>N>O����ͬ����Ԫ�أ�ͬ���ڴ���������������������ǿ���縺�������縺�ԵĴ�С��ϵΪ C<N<O���ڶ���N����2�����һ��̼��������̼��,����һ�Թ¶Ե���,�������ԭ�Ӽ۵��Ӳ㹲��4��3+1���Ե���,����sp3�������ӻ������ǻ���O����1�����һ��̼,����2�Թ¶Ե���,�������ԭ�Ӽ۵��Ӳ㹲��4��2+2���Ե���,����sp3�������ӻ���ͬ��S��������̼,����2�Թ¶Ե���,�������ԭ�Ӽ۵��Ӳ㹲��4��2+2���Ե���,����sp3�������ӻ����ʲ���sp3�ӻ���ԭ����C��S��N��O����4��NO3����N����sp2�ӻ�������ԭ����Χ���Ե��Ӷԣ����Կռ乹��Ϊƽ�������Σ�д��һ����NO3����Ϊ�ȵ������һ�ַǼ��Է��ӵĻ�ѧʽ ����SO3����ǰ������Ԫ��ԭ�ӹ��ɵķǼ��Է��ӻ�ѧʽ������BF3����5���Ҵ���������������,ʹ���Ҵ����ǻ��ϵ������һ���Ҵ������е����γ�������Ҵ�����Է���������������С������е��������ߣ�����Ϊ�Ҵ����Ӽ������� ��һ�������к���Fe��8��18+6��12=4��Nԭ��1���������Ħ������Ϊ56��4+14=238�����������Feԭ�Ӽ�ľ���Ϊa cm�������ı߳�Ϊ
��1 mol CO2�����к��ЦҼ������ʵ���Ϊ 2mol����3����ͬ����Ԫ��ԭ��ԭ������Խ��ԭ�Ӱ뾶ԼС����Ϊԭ������Խ��ԭ�Ӻ�����Խ�Ե��ӵ�����Խ��ԭ�ӵİ뾶��ԽС��C��N��Oԭ�Ӱ뾶�Ĵ�С��ϵΪC>N>O����ͬ����Ԫ�أ�ͬ���ڴ���������������������ǿ���縺�������縺�ԵĴ�С��ϵΪ C<N<O���ڶ���N����2�����һ��̼��������̼��,����һ�Թ¶Ե���,�������ԭ�Ӽ۵��Ӳ㹲��4��3+1���Ե���,����sp3�������ӻ������ǻ���O����1�����һ��̼,����2�Թ¶Ե���,�������ԭ�Ӽ۵��Ӳ㹲��4��2+2���Ե���,����sp3�������ӻ���ͬ��S��������̼,����2�Թ¶Ե���,�������ԭ�Ӽ۵��Ӳ㹲��4��2+2���Ե���,����sp3�������ӻ����ʲ���sp3�ӻ���ԭ����C��S��N��O����4��NO3����N����sp2�ӻ�������ԭ����Χ���Ե��Ӷԣ����Կռ乹��Ϊƽ�������Σ�д��һ����NO3����Ϊ�ȵ������һ�ַǼ��Է��ӵĻ�ѧʽ ����SO3����ǰ������Ԫ��ԭ�ӹ��ɵķǼ��Է��ӻ�ѧʽ������BF3����5���Ҵ���������������,ʹ���Ҵ����ǻ��ϵ������һ���Ҵ������е����γ�������Ҵ�����Է���������������С������е��������ߣ�����Ϊ�Ҵ����Ӽ������� ��һ�������к���Fe��8��18+6��12=4��Nԭ��1���������Ħ������Ϊ56��4+14=238�����������Feԭ�Ӽ�ľ���Ϊa cm�������ı߳�Ϊ![]() ����þ�����ܶȼ���ʽΪ
����þ�����ܶȼ���ʽΪ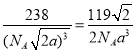 ��
��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�