题目内容
15.NA表示阿伏加德罗常数的值,下列说法中正确的是( )| A. | 含0.1 mol BaCl2的溶液中Cl-数为0.1NA | |
| B. | 1molCl2与足量Fe反应,转移的电子数为3NA | |
| C. | 11.2 L CO2所含有的分子数为0.5NA | |
| D. | 标准状况下,分子数为NA的CO、N2混合气体体积约为22.4 L,质量为28 g |
分析 A.0.1mol氯化钡中含有0.2mol氯离子;
B.1mol氯气与铁完全反应最多得到2mol电子;
C.不是标准状况下,不能使用标况下的气体摩尔体积计算二氧化碳的物质的量;
D.CO和氮气的摩尔质量都是28g/mol,标况下分子数为NA的CO、N2混合气体的物质的量为1mol,体积约为22.4L.
解答 解:A.0.1molBaCl2中含有氯离子的物质的量为0.2mol,含有的Cl-数为0.2NA,故A错误;
B.1mol氯气与铁完全反应生成氯化铁,最多得到2mol电子,根据电子守恒,转移的电子数为2NA,故B错误;
C.没有告诉在标准状况下,不能使用标况下的气体摩尔体积计算11.2L二氧化碳的物质的量,故C错误;
D.标况下分子数为NA的CO、N2混合气体的物质的量为1mol,由于CO和氮气的摩尔质量都是28g/mol,则1mol该混合气体的质量为28g、体积约为22.4L,故D正确;
故选D.
点评 本题考查阿伏伽德罗常数的综合应用,题目难度中等,注意明确标况下气体摩尔体积的使用条件,熟练掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间的转化关系,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
5.在一定条件下,对于密闭容器中进行的可逆反应A(g)+3B(g)?2C(g),下列说法能证明这一反应已经达到化学平衡状态的是( )
| A. | 单位时间消耗nmol A,同时生成2nmolC | |
| B. | A,B,C的分子数之比为1:2:3 | |
| C. | A,B,C的浓度相等 | |
| D. | 生成C的速率与分解C的速率相等 |
3.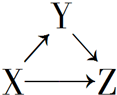 X、Y、Z有如图所示的转化关系,则X和Y可能是( )
X、Y、Z有如图所示的转化关系,则X和Y可能是( )
①Si和SiO2 ②AlCl3和Al(OH)3③CuO和CuSO4 ④Fe和FeCl2.
 X、Y、Z有如图所示的转化关系,则X和Y可能是( )
X、Y、Z有如图所示的转化关系,则X和Y可能是( )①Si和SiO2 ②AlCl3和Al(OH)3③CuO和CuSO4 ④Fe和FeCl2.
| A. | ①②③④ | B. | ①② | C. | ③④ | D. | ①②③ |
10.R元素的原子有3个电子层,M层电子数是K层电子数的3倍,对R元素的判断不正确的是( )
| A. | R元素处于第三周期ⅥA族 | B. | R元素是较活泼的非金属元素 | ||
| C. | 原子核外共有14个电子 | D. | 元素最低化合价为-2价 |
20.欲制取较纯净的1,2二氯乙烷,可采取的方法是( )
| A. | 乙烯与HCl加成 | |
| B. | 乙烯与Cl2加成 | |
| C. | 乙烷与Cl2按1:2的体积比在光照条件下反应 | |
| D. | 乙烯先与HCl加成,再与等物质的量的Cl2在光照下反应 |
7.在元素周期表中有很多的规律与特点,下列说法不正确的是( )
| A. | 两种不同的元素不可能既在同一周期,又在同一主族 | |
| B. | 元素周期表中的元素不全是从自然界中发现的 | |
| C. | 周期表中共1-20号元素,含有非金属11种 | |
| D. | 若周期表中第8周期完全填满,此周期应含有有50种元素 |
4.由碘乙烷制取乙二醇,依次发生反应的类型是( )
| A. | 取代、加成、水解 | B. | 消去、加成、取代 | C. | 水解、消去、加成 | D. | 消去、水解、取代 |
11.在室温下,下列各组微粒在溶液中能大量共存的是( )
| A. | Na+、Ba2+、NO3-、Cl-、 | B. | H+、Fe2+、ClO-、SO42- | ||
| C. | K+、Fe3+、C6H5O-、SCN- | D. | NH4+、Al3+、SiO32-、CO32- |
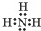 ;NH3在同族元素形成的氢化物中具有较高的沸点,其原因是NH3分子间有氢键.
;NH3在同族元素形成的氢化物中具有较高的沸点,其原因是NH3分子间有氢键.