题目内容
10.R元素的原子有3个电子层,M层电子数是K层电子数的3倍,对R元素的判断不正确的是( )| A. | R元素处于第三周期ⅥA族 | B. | R元素是较活泼的非金属元素 | ||
| C. | 原子核外共有14个电子 | D. | 元素最低化合价为-2价 |
分析 R元素的原子有3个电子层,M层电子数是K层电子数的3倍,M层电子数为6,故R为S元素,据此解答.
解答 解:R元素的原子有3个电子层,M层电子数是K层电子数的3倍,M层电子数为6,故R为S元素.
A.S元素处于第三周期ⅥA族,故A正确;
B.硫元素属于较活泼的非金属元素,故B正确;
C.硫元素原子核外有16个电子,故C错误;
D.硫元素最外层电子数为6,故其最低化合价为6-8=-2价,故D正确,
故选C.
点评 本题考查结构位置性质关系应用,比较基础,侧重对基础知识的巩固.

练习册系列答案
相关题目
20.下列图示与对应的叙述相符的是( )
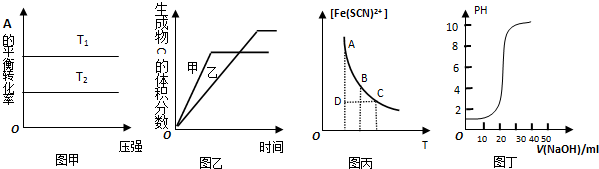

| A. | 由图甲可以判断:对于反应a A (g)+b B (g)?cC (g),若T1>T2,则a+b=c,且△H<0 | |
| B. | 图乙表示温度对可逆反应2A (g)+2 B (g)?3C (g)+D (g)的影响,甲的温度比乙的温度高且正反应为吸热 | |
| C. | 图丙表示可逆反应Fe3+(aq)+SCN-(aq)?Fe(SCN)2+(aq)平衡时,物质的量浓[Fe(SCN)2+]与温度T的关系,反应处于D点时,一定有V(正)>V(逆) | |
| D. | 图丁表示用0.1000mol/L的NaOH溶液滴定20.00ml,0.1000mol/L的醋酸溶液得到的滴定曲线 |
1.下列关于有机化合物的说法错误的是( )
| A. | 乙醇和乙酸都存在羟基 | |
| B. | 甲烷和甲苯都可以与氯气反应 | |
| C. | 高锰酸钾可以氧化甲苯和乙醛 | |
| D. | 乙烯可以发生加成反应,苯不能发生加成反应 |
18.重水(D2O)是重要的核工业原料,下列说法错误的是( )
| A. | H2O与D2O互称同素异形体 | |
| B. | 1H与D互称同位素 | |
| C. | 氘(D)原子核外有1个电子 | |
| D. | 1H218O与D216O的相对分子质量相同 |
5.把含硫酸铵和硝酸铵的混合液2a L分成两等份.一份加入bmol NaOH并加热,恰好把NH3全部赶出;另一份需消耗cmol BaCl2沉淀反应恰好完全,则原溶液中NO3-的浓度为( )
| A. | $\frac{b-2c}{a}$ | B. | $\frac{2b-4c}{a}$ | C. | $\frac{2b-c}{a}$ | D. | $\frac{b-4c}{a}$ |
15.NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 含0.1 mol BaCl2的溶液中Cl-数为0.1NA | |
| B. | 1molCl2与足量Fe反应,转移的电子数为3NA | |
| C. | 11.2 L CO2所含有的分子数为0.5NA | |
| D. | 标准状况下,分子数为NA的CO、N2混合气体体积约为22.4 L,质量为28 g |
2.用括号中的试剂和方法除去各物质中的少量杂质,正确的是( )
| A. | 苯中的甲苯(溴水、分液) | B. | 乙醇中的乙酸(NaOH溶液,分液) | ||
| C. | 乙醇中的水(新制CaO,蒸馏) | D. | 乙酸乙酯中的乙酸(NaOH溶液,分液) |
6.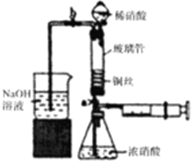 利用下列装置可实现铜与浓硝酸、稀硝酸反应,过程如下:
利用下列装置可实现铜与浓硝酸、稀硝酸反应,过程如下:
Ⅰ.取一段铜丝,用稀硫酸除去铜锈[主要成分是Cu2(OH)2CO3];
Ⅱ.将洗涤后的铜丝做成匝数较多的螺旋状;
Ⅲ.按如图所示装置连接仪器,检查气密性,装入化学试剂.
(1)写出Cu丝在空气中形成铜绿的化学反应方程式2Cu+CO2+O2+H2O=Cu2(OH)2CO3;
(2)将铜丝烧成螺旋状的原因是增大铜丝与酸的接触面积,提高化学反应速率,写出过程Ⅲ中检查气密性的方法打开b和a,关闭分液漏斗的活塞,将左边导管插入盛水的烧杯中,轻轻拉动注射器活塞,若导管中液面上升则说明气密性好;
(3)过程Ⅲ的后续操作如下:
①打开止水夹a和b,轻推注射器,使浓硝酸与铜丝接触,观察到的现象是产生红棕色气体,一段时间后使反应停止的操作是轻轻将注射器活塞向右拉使铜丝和溶液分开,关闭a,取下注射器;
②打开b和分液漏斗活塞,当玻璃管充满稀硝酸后,关闭b和分液漏斗活塞,打开a,观察到有气泡产生,稀硝酸充满玻璃管的实验目的是将玻璃管中的NO2和空气排出,该反应的离子方程式是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(4)另取3支盛满NO2气体的小试管分别倒置在盛有常温水、热水和冰水的3只烧杯中,发现液面上升的高度明显不一致,结果如表所示(忽略温度对气体体积的影响):
①根据上表得出的结论是温度越低(填“高”或“低”),进入试管中的溶液越多;
②假设反应在标准状况下进行,小试管的容积为VL,将小试管倒立在盛有足量水的水槽中,若溶液溶质不扩散,则得到的溶液的物质的量浓度是$\frac{1}{22.4}$mol/L,若使液体充满试管,应该充入氧气的体积是$\frac{V}{4}$L.
 利用下列装置可实现铜与浓硝酸、稀硝酸反应,过程如下:
利用下列装置可实现铜与浓硝酸、稀硝酸反应,过程如下:Ⅰ.取一段铜丝,用稀硫酸除去铜锈[主要成分是Cu2(OH)2CO3];
Ⅱ.将洗涤后的铜丝做成匝数较多的螺旋状;
Ⅲ.按如图所示装置连接仪器,检查气密性,装入化学试剂.
(1)写出Cu丝在空气中形成铜绿的化学反应方程式2Cu+CO2+O2+H2O=Cu2(OH)2CO3;
(2)将铜丝烧成螺旋状的原因是增大铜丝与酸的接触面积,提高化学反应速率,写出过程Ⅲ中检查气密性的方法打开b和a,关闭分液漏斗的活塞,将左边导管插入盛水的烧杯中,轻轻拉动注射器活塞,若导管中液面上升则说明气密性好;
(3)过程Ⅲ的后续操作如下:
①打开止水夹a和b,轻推注射器,使浓硝酸与铜丝接触,观察到的现象是产生红棕色气体,一段时间后使反应停止的操作是轻轻将注射器活塞向右拉使铜丝和溶液分开,关闭a,取下注射器;
②打开b和分液漏斗活塞,当玻璃管充满稀硝酸后,关闭b和分液漏斗活塞,打开a,观察到有气泡产生,稀硝酸充满玻璃管的实验目的是将玻璃管中的NO2和空气排出,该反应的离子方程式是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(4)另取3支盛满NO2气体的小试管分别倒置在盛有常温水、热水和冰水的3只烧杯中,发现液面上升的高度明显不一致,结果如表所示(忽略温度对气体体积的影响):
| 实验编号 | 水温/℃ | 液面上升高度 |
| 1 | 25 | $\frac{2}{3}$ |
| 2 | 50 | 不足试管的$\frac{2}{3}$ |
| 3 | 0 | 液面上升超过实验1 |
②假设反应在标准状况下进行,小试管的容积为VL,将小试管倒立在盛有足量水的水槽中,若溶液溶质不扩散,则得到的溶液的物质的量浓度是$\frac{1}{22.4}$mol/L,若使液体充满试管,应该充入氧气的体积是$\frac{V}{4}$L.