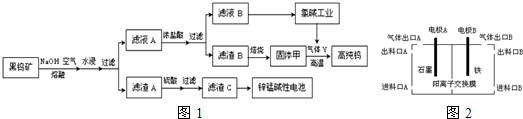
题目内容
6.短周期元素N、Na、Al形成的物质在工农业生产、生活中应用广泛.(1)Al在元素周期表中的位置为第三周期,第ⅢA族;其原子半径比Na小(填“大”或“小”).
(2)Al单质在空气中不易腐蚀,原因是其表面形成了一种致密的且熔点高的化合物.该化合物的类型为离子化合物;该化合物遇酸碱易被腐蚀,请写出它与NaOH溶液反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
(3)NH3的电子式为
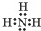 ;NH3在同族元素形成的氢化物中具有较高的沸点,其原因是NH3分子间有氢键.
;NH3在同族元素形成的氢化物中具有较高的沸点,其原因是NH3分子间有氢键.(4)氮元素的最高价氧化物的水化物与其最低价氢化物反应的化学方程式为HNO3+NH3=NH4NO3.
(5)NF3是一种新型电子材料,常温下为稳定气体,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和某种物质.请写出反应的化学方程式3NF3+5H2O=9HF+2NO+HNO3.
分析 (1)铝有3个电子层,最外层3个电子;同周期原子半径从左到右依次减小;
(2)该氧化物为氧化铝,氧化铝晶体为离子晶体;氧化铝为两性氧化物,能够与氢氧化钠反应生成偏铝酸钠和水;
(3))氨气属于共价化合物;其分子中含有3个氮氢键,据此写出其电子式;氨气分子中存在氢键,导致其沸点较高;
(4)氮元素的最高价氧化物的水化物为硝酸,其最低价氢化物为氨气,硝酸与氨气反应生成硝酸铵;
(5)根据反应物、生成物书写方程式,该反应中N元素化合价由+3价变为+2价、+5价,则NF3既是氧化剂又是还原剂,依据得失电子守恒写出方程式.
解答 解:(1)铝有3个电子层,最外层3个电子,在周期表中第三周期,第ⅢA族;同周期原子半径从左到右依次减小,铝与钠位于同周期,在钠的右侧,原子半径小于钠原子;
故答案为:第三周期,第ⅢA族;小;
(2)Al单质在空气中不易腐蚀,原因是其表面形成了一种致密的且熔点高的化合物氧化铝,氧化铝属于离子晶体;氧化铝具有两性,能够与氢氧化钠溶液反应生成偏铝酸钠和水,反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O,
故答案为:离子化合物;Al2O3+2OH-=2AlO2-+H2O;
(3)氨气属于共价化合物,其电子式为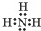 ;氨气中N的电负性较强,容易形成氢键,大大增强了分子间作用力,所以其沸点较高,
;氨气中N的电负性较强,容易形成氢键,大大增强了分子间作用力,所以其沸点较高,
故答案为: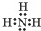 ; NH3分子间有氢键;
; NH3分子间有氢键;
(4)氮元素的最高价氧化物的水化物为硝酸,其最低价氢化物为氨气,硝酸与氨气反应生成硝酸铵,方程式:HNO3+NH3=NH4NO3;
故答案为:HNO3+NH3=NH4NO3;
(5)反应物是NF3和水,生成物是HF、NO、HNO3,该反应中N元素化合价由+3价变为+2价、+5价,根据转移电子守恒及原子守恒配平方程式为3NF3+5H2O=9HF+2NO+HNO3,故答案为:3NF3+5H2O=9HF+2NO+HNO3.
点评 本题考查了化学方程式书写,原子结构与周期表的关系,电子式的书写,氢键对物质性质的影响,题目综合性强,难度中等,注意氢键只影响物质的物理性质.

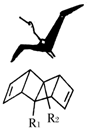 始祖鸟烯形状宛如一只展翅飞翔的鸟,其键线式结构表示如图,其中R1、R2为烷烃基.则下列有关始祖鸟烯的说法中正确的是( )
始祖鸟烯形状宛如一只展翅飞翔的鸟,其键线式结构表示如图,其中R1、R2为烷烃基.则下列有关始祖鸟烯的说法中正确的是( )| A. | 始祖鸟烯与乙烯互为同系物 | |
| B. | 若R1=R2=甲基,则其化学式C12H14 | |
| C. | 若R1=R2=甲基,则始祖鸟烯的一氯代物有3种 | |
| D. | 始祖鸟烯既能使酸性高锰酸钾褪色,也能使溴水褪色,则两反应的反应类型是相同的 |
| A. | 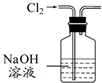 装置除去Cl2中含有的少量HCl | |
| B. | 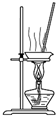 装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 | |
| C. | 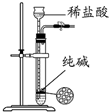 装置制取少量纯净的CO2气体 | |
| D. | 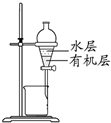 装置分离CCl4萃取碘水后已分层的有机层和水层 |
| A. | 乙醇和乙酸都存在羟基 | |
| B. | 甲烷和甲苯都可以与氯气反应 | |
| C. | 高锰酸钾可以氧化甲苯和乙醛 | |
| D. | 乙烯可以发生加成反应,苯不能发生加成反应 |
| A. | H2O与D2O互称同素异形体 | |
| B. | 1H与D互称同位素 | |
| C. | 氘(D)原子核外有1个电子 | |
| D. | 1H218O与D216O的相对分子质量相同 |
| A. | 含0.1 mol BaCl2的溶液中Cl-数为0.1NA | |
| B. | 1molCl2与足量Fe反应,转移的电子数为3NA | |
| C. | 11.2 L CO2所含有的分子数为0.5NA | |
| D. | 标准状况下,分子数为NA的CO、N2混合气体体积约为22.4 L,质量为28 g |
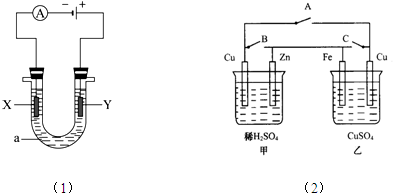
 实验室用如图所示的装置制取乙酸乙酯.
实验室用如图所示的装置制取乙酸乙酯. CH3COOC2H5+H2O,乙酸乙酯的密度比水小(填“大”或“小”),有果香味.
CH3COOC2H5+H2O,乙酸乙酯的密度比水小(填“大”或“小”),有果香味.